
Борис Кудрявцев
ПЕРВОНАЧАЛА ВЕЩЕЙ
Очерк о строении вещества
I
ХАОС
Вместо введения
Сегодня утром работа не клеилась. Возможно, оказывалось утомление от напряженной работы в течение зимы, возможно и то, что теплый весенний ветер пробуждал заложенное в каждом человеке стремление с наступлением солнечных дней, сменяющих зимнюю непогоду, уезжать из города в лес, в поле…
Попытки сосредоточиться были бесплодны: мысли разбегались, и решение, казалось бы, несложной задачи никак не давалось в руки. Сложив папки с расчетами и взяв с книжной полки последний номер литературного журнала, я закрыл двери лаборатории и уже через полчаса шел по широкой аллее пригородного парка.
В парке было людно. Студенты и школьники в одиночку и группами готовились к предстоящим экзаменам. Более молодое поколение, не обремененное еще школьными заботами, со свойственной ему непосредственностью наслаждалось теплым солнечным днем.
В одной из боковых аллей нашлась свободная скамейка. Рядом со мной на скамейке сидела молодая женщина с толстой книгой, по-видимому учебником. Время от времени она отрывалась от чтения и следила взглядом за маленьким мальчиком, пускавшим в небольшом пруду деревянный кораблик. Легкий ветер прибивал кораблик к берегу, и он никак не хотел отправляться в плавание. Обескураженный неудачей, мальчуган вытащил из воды свой кораблик, подошел к скамейке и осторожно тронул за руку мою соседку.
Женщина подняла глаза от книги.
— В чем дело, Андрюша? Почему ты не играешь?
Мальчик пристально смотрел на мать.
— Мама, а почему вода жидкая?
— Ну что ты, Андрюша! Ты опять задаешь глупые вопросы. Вода жидкая, потому что она вода. Иди играй! — и она снова наклонилась над книгой.
По выражению глаз мальчика было видно, что его не удовлетворил ответ матери. Он снова потянул ее за руку:
— Мама, но почему вода жидкая, а лед твердый?
— Ах, Андрюша, сколько раз я тебе говорила, что лед твердый, потому что лед — это замерзшая вода. Иди пускай свой кораблик.
Малыш постоял еще мгновение в нерешительности, потом взял кораблик и пошел к пруду. Что-то неуловимое в его походке и всей фигуре говорило о том, что «глупые вопросы» продолжали его интересовать.
И впрямь, так ли уж глупы вопросы, занимавшие мальчика? В самом деле, почему одни тела жидкие, другие твердые, а третьи газообразные? Почему, если жидкость охлаждать, она превращается в твердое тело, а если нагревать, то в пар?
Может ли наука в наше время ответить на это? Мысленно я старался проследить, как обогащалось человеческое знание, как находил человек правильные ответы на эти, казалось бы, совсем простые вопросы.
Во глубине веков
Примерно две с половиной тысячи лет тому назад, в V веке до нашего летосчисления, на омываемом теплым Средиземным морем Балканском полуострове достигло расцвета античное греческое государство. Это был золотой век классического искусства, науки, философии. До нашего времени непревзойденными остаются замечательные творения греческих скульпторов. Мы с восхищением любуемся сохранившимися памятниками античной архитектуры, с восторгом читаем бессмертные творения Гомера, Еврипида, Аристофана… Драгоценный памятник греческой культуры — сочинения философов и ученых, подводящие итог знаниям, которые приобрел человек, присматриваясь к явлениям окружающей его природы, пытаясь понять их, объяснить закономерности, которым они подчиняются. Подмечая на каждом шагу взаимную связь различных явлений, люди воспринимали природу во всем ее многообразии как нечто единое, целое.
Две отличительные черты окружающего мира особенно бросались в глаза человеку. Первой из них была постоянная изменчивость природы. Смена времен года резко меняла облик земли. За цветущей весной и жарким летом неизбежно приходили осень и холодная зима. Жизнь в природе замирала, для того чтобы вновь возродиться с приходом весны. Морские прибои подмывали высокие берега, меняя их очертания. Лесной пожар, начавшийся от неосторожно разложенного пастухами костра, пожирал огромные стволы вековых деревьев. Горный обвал мог превратить цветущую долину в пустыню. Все люди, и раб и полководец, умирали и после сжигания превращались в пепел. В мире все изменчиво, нет ничего постоянного, все течет, все изменяется: день сменяется ночью, летний жар — зимним холодом, здоровье — болезнью…
«На того, кто входит в ту же самую реку, каждый раз текут новые воды… В одну и ту же реку невозможно войти дважды», — говорил один из греческих мудрецов, Гераклит Эфесский, подчеркивая мысль, что все в природе непрерывно изменяется.
Второй особенностью природы, подмеченной человеком, была своеобразно сочетающаяся с изменчивостью вечность окружающего мира. Действительно, оголенная зимними холодами горная вершина вновь покрывалась весною цветущим ковром; на месте уничтоженного пожаром леса возникала поросль, превращавшаяся через несколько десятилетий в густой лес. Место умерших людей и животных занимали рождающиеся вновь… И так было везде и во всем. Мир изменчив и в то же самое время вечен. Непрерывно изменяясь, природа вновь и вновь воспроизводит себя.
Попыткой объяснить эту противоречивость природы была гениальная догадка классической древности — материалистическое учение об атомах. Наиболее полно это учение изложил греческий философ и ученый Демокрит.
Атомы
Демокрит родился около 460 года до нашего летосчисления в греческом городе Абдере. По дошедшим до нас сведениям, это был энциклопедически образованный человек. Все интересовало его: физика, математика, философия, медицина, техника…
Главное сочинение Демокрита, «Великий диакосмос», посвящено учению о строении мира.
Демокрит думал, что окружающий мир состоит из мельчайших частиц. Эти частицы он считал неделимыми и назвал поэтому атомами (атом — по-гречески неделимый).
Атомы, по его мысли, вечны и неизменны, многообразие же окружающей нас природы вызвано различным движением и различными сочетаниями атомов.
«Все состоит из атомов… вещи отличаются друг от друга атомами, из которых они состоят, их порядком и положением…» — писал Демокрит. Атомы находятся в непрерывном движении, и это движение — причина изменчивости мира. Сами атомы неизменны, и в этом объяснение вечности мира. Двигаясь беспорядочно, атомы приближаются друг к другу, образуют скопления. В одном случае такое скопление может быть водой, в другом случае — камнем, в третьем — растением. Спустя некоторое время в результате движения атомов эти скопления изменятся: вода испарится, растение увянет… Но вечность атомов и их движения обеспечивает повторное возникновение исчезнувших скоплений атомов, поэтому окружающий нас мир вечен.
Тем, что все состоит из атомов, Демокрит объяснял многие хорошо известные свойства вещей. Так, например, аромат цветов, по его мнению, мы чувствуем потому, что вылетающие из чашечки цветка атомы попадают в нос человека и вызывают ощущение запаха. Соленый вкус морскому воздуху придают атомы соли, уносимые ветром вместе с капельками морской воды. Горький, соленый, острый вкус различных тел, как считал Демокрит, зависит от формы их атомов. Пользуясь атомным учением, он объяснял разнообразные явления природы: возникновение облаков, громовые раскаты, зарницы и многое другое.
 Рис. 1.
Так Демокрит объяснял, почему пахнут цветы.
Рис. 1.
Так Демокрит объяснял, почему пахнут цветы.
В древности взгляды Демокрита пользовались широким распространением. В I веке до нашей эры замечательный римский поэт и философ Тит Лукреций Кар рассказал об атомах в своей бессмертной поэме «О природе вещей». Поэтичные строки поэмы запоминались лучше ученых трактатов.
Вот посмотри: всякий раз, когда солнечный свет проникает
В наши жилища и мрак прорезает своими лучами,
Множество маленьких тел в пустоте ты увидишь; мелькая,
Мечутся взад и вперед в лучистом сиянии света;
Будто бы в вечной борьбе они бьются в сраженьях и битвах,
В схватки бросаются вдруг по отрядам, не зная покоя,
Или сходясь или врозь постоянно опять разлетаясь.
Можешь из этого ты уяснить себе, как неустанно
Первоначала вещей в пустоте необъятной мятутся.
Так о великих вещах помогают составить понятье
Малые вещи, пути намечая для их постиженья.
Кроме того, потому обратить тебе надо вниманье
На суматоху в телах, мелькающих в солнечном свете,
Что из нее познаешь ты материи также движенья,
Происходящие в ней потаенно и скрыто от взора.
Ибо увидишь ты там, как много пылинок меняют
Путь свой от скрытых толчков и опять отлетают обратно,
Вечно туда и сюда разбегаясь во всех направленьях.
Знай же: идет от начал всеобщее это блужданье.
Первоначала вещей сначала движутся сами,
Следом за ними тела из малейшего их сочетанья,
Близкие, как бы сказать, по силам к началам первичным;
Скрыто от них получая толчки, начинают стремиться
Сами к движенью, затем понуждая тела покрупнее.
Так, исходя от начал, движение мало-помалу
Наших касается чувств, и становится видимым также
Нам и в пылинках оно, что движутся в солнечном свете,
Хоть незаметны толчки, от которых оно происходит
[1], —
писал Лукреций.
Так же как и Демокриту, атомы помогали ему объяснить природу различных явлений.
Атомное учение по самой своей сущности глубоко материалистично. В мире, состоящем из движущихся атомов и пустого пространства, не остается места для божества. Самые различные явления природы находят себе простое объяснение без помощи каких-либо сверхъестественных сил. Неспроста же на протяжении многих столетий, прошедших со времени Демокрита, все материалистические учения сознательно связывали возникновение материализма с именем великого атомиста. Движения атомов и их соударения подчиняются простым и строгим законам, исключающим божественную волю, отрицающим существование чудес и необъяснимых явлений. Материалистическая сущность атомизма была одной из главных причин того, почему спустя несколько столетий судьба учения Демокрита резко изменилась. После распада Римской рабовладельческой империи огромное влияние приобрела христианская церковь. Сделавшись официальной государственной религией, христианство всеми силами стремилось уничтожить классическую науку и искусство, объявив их языческими. Интерес к ним церковь считала грехом. В 390 году архиепископ Феофил явился вдохновителем разрушения Александрийской библиотеки, этой сокровищницы мировой культуры. Преследовалось само стремление к знанию, если только оно не было направлено на утверждение христианского учения. Строго запрещалось чтение научных книг. От церковных властей старались не отстать и власти светские. В феврале 1626 года парижский парламент под страхом смертной казни запретил распространять мысль о том, что все в мире состоит из атомов. Однако как бы ни были строги парламентские акты и постановления церковных соборов, они не могли остановить развитие науки. Прошло несколько лет после грозного акта парламента, и именно в Париже вновь возродились идеи Демокрита. Их выразителем явился французский философ Пьер Гассенди.
По стопам Демокрита
Родиной Гассенди была солнечная провинция Франции — Прованс. Будущий философ родился в 1592 году в семье бедных поселян близ города Динь. Один из родственников дал ему возможность учиться философии в городе Экс. Обладая недюжинными способностями, Гассенди уже 16-летним юношей становится учителем риторики.
Смело восстав против невежества средневековой науки и освященного церковью авторитета философа-идеалиста Аристотеля, Гассенди проповедует в своих сочинениях атомное учение.
Дробить тело до бесконечности нельзя, утверждает он. Все тела состоят из неделимых частиц, или атомов. Атомы бывают разнообразной формы: некоторые угловаты, другие шаровидны, есть и заостренные, есть и гладкие…
Если атомы сцеплены между собой лишь в немногих точках, то тело бывает жидким; напротив, если они соприкасаются многими точками, то тело бывает твердым.
Атомы, как правило, объединяются в более крупные частички, наподобие того, как отдельные буквы объединяются в слова. Эти более крупные частички Гассенди назвал молекулами, от латинского слова «молес», что означает — масса.
Среди ученых того времени взгляды Гассенди нашли себе как горячих приверженцев, так и не менее горячих противников. Широко пользовался атомным учением в своих работах английский физик Роберт Бойль.
Великий английский ученый Ньютон считал, что все тела состоят из «имеющих массу, крепких, непроницаемых, движущихся частичек…», то-есть атомов; эта идея помогала ему правильно объяснять явления природы.
Не надо думать, однако, что после Гассенди атомное учение сделалось господствующим в науке. Его противники были более многочисленны, чем его сторонники. В числе противников учения Гассенди об атомах был его современник и соотечественник, крупнейший философ, физик и математик Рене Декарт, считавший, что вещество можно делить беспредельно. Не признавал существования материальных атомов и гениальный немецкий математик, философ-идеалист Готфрид Лейбниц.
Справедливость требует отметить, что в сочинениях Гассенди было много непоследовательного. Он считал, например, что наряду с материальными, вещественными атомами существуют особые атомы холода, атомы тепла и даже… атомы души!
На взглядах Гассенди лежит печать двойственности, попытки примирить материалистический взгляд на природу с существованием бога. Эта двойственность не способствовала успеху учения об атомах.
Проходит еще около ста лет, и атомное учение находит себе нового замечательного защитника — великого русского ученого Михаила Васильевича Ломоносова. Ломоносов не только признает справедливость атомного строения окружающих тел, — он использует учение об атомах для объяснения различных свойств и превращений вещества. Атомное учение помогло Ломоносову правильно объяснить, что такое теплота, понять, почему газы сопротивляются сжатию, найти законы, которые позволили в дальнейшем строить более совершенные машины, и т. д.
 Рис. 2. Так представлял себе Ломоносов столкновения и взаимодействия молекул.
Рис. 2. Так представлял себе Ломоносов столкновения и взаимодействия молекул.
М. В. Ломоносов
М. В. Ломоносов родился в 1711 году.
В истории человечества известно много величайших ученых, художников, поэтов. Однако вряд ли мы найдем среди них другого человека, столь богато и разносторонне одаренного, как М. В. Ломоносов.
Трудно охватить круг его интересов — так он велик. А. С. Пушкин писал о Ломоносове, что он «…соединяя необыкновенную силу воли с необыкновенною силою понятия… обнял все отрасли просвещения… Историк, ритор, механик, химик, минералог, художник и стихотворец, он все испытал и все проник…»
Разносторонность таланта Ломоносова поражала иностранцев, они не могли представить себе, что это был один человек. Еще недавно в некоторых иностранных книгах по истории химии писали, что существовало два Ломоносова: один химик, а другой поэт!
Как и все лучшие сыны русского народа, Ломоносов горячо любил родину и много сил положил на укрепление ее мощи, на улучшение жизни народа. Заботясь о распространении знаний, Ломоносов был фактическим основателем Московского университета, являющегося до сих пор одним из крупнейших научных центров нашей страны.
В самых различных областях знания работал Ломоносов. Но особенно много занимался он физикой и химией. Ломоносов создал первую в России химическую лабораторию, предназначенную для чисто научных исследований. Раньше других он понял значение взвешивания веществ при химических превращениях.
Производя опыты, Ломоносов подтвердил великий закон природы, открытый им раньше.
Еще в 1748 году Ломоносов писал: «Все перемены в природе случающиеся такого суть состояния, что сколько чего у одного тела отнимется, столько присоединится к другому… Сей всеобщий естественный закон простирается и в самые правила движения…» Значение этого всеобщего закона сделалось ясным только в наше время. Первую часть открытого закона — закон сохранения массы — Ломоносов подтвердил в 1756 году тщательными опытами. Через 17 лет после Ломоносова ею опыты повторил и расширил талантливый французский химик Лавуазье, способствуя тем самым утверждению закона сохранения массы в химии. Спустя сто лет, в 1842 году, немецкий врач Р. Майер сформулировал закон, получивший в дальнейшем название «закона сохранения энергии». Мы знаем теперь, что этот закон является одной из конкретных формулировок общего закона, сформулированного Ломоносовым. Ломоносов первый увидел обе стороны открытого им всеобщего закона. Объединенный закон сохранения массы и энергии должен по справедливости называться законом Ломоносова.
 Рис. 3. Приборы, изобретенные Ломоносовым.
Рис. 3. Приборы, изобретенные Ломоносовым.
На протяжении последних ста лет закон Ломоносова был тем фундаментом, на который опиралось развитие науки и техники. Именно знание этого закона обеспечило сказочный технический прогресс, свидетелями которого мы являемся. В последние десятилетия, когда ученые напряженно трудились, пытаясь раскрыть тайны строения атома, закон сохранения массы и энергии был той путеводной нитью, которая направляла поиски исследователей, уменьшала опасность сбиться с правильного пути и сделать ложные выводы. Без знания этого закона невозможно было бы овладеть огромными запасами энергии, скрытыми в атомных ядрах. И в наши дни гениальная мысль о существовании закона сохранения материи в широком смысле слова раскрывается в новых конкретных формах.
Изучая свойства тел, великий русский ученый объяснил истинную причину таких свойств, как упругость газов, нагревание тел при трении и т. д.
Что происходит с телами при нагревании? Что такое тепло? Почему тела притягиваются к земле? Почему газ сопротивляется сжатию? Почему тело, выставленное на мороз, охлаждается? Эти вопросы особенно интересовали науку во времена Ломоносова.
В то время в европейской науке существовал один ответ на все перечисленные выше вопросы. Для объяснения непонятных явлений наука располагала тогда целым набором таинственных «невесомых веществ», или, как их называли, «материй». Например, существовали «невесомая тепловая материя», «невесомая материя упругости», «материя холода» и т. д. При помощи этих «материй» можно было на словах объяснить все что угодно, по существу не объясняя ничего. Вас, например, интересует, почему вода в чайнике, поставленном на огонь, нагревается. Ответ готов: невесомая тепловая материя, выделяемая огнем, входит в воду, и вода нагревается!
Вы хотите знать, почему газ сопротивляется сжатию? Потому что в нем имеется невесомая материя упругости, которая и противится уменьшению объема, занимаемого газом.
Такое «объяснение» непонятных явлений напоминает рассуждение невежественного врача в одной из мольеровских комедий, который объяснял снотворное действие опия, содержащегося в зернах мака, тем, что опий «обладает усыпляющими свойствами»!
Ясно, что такого рода объяснения ничего не объясняют, не помогают понять, почему в природе происходят те или иные явления.
И вот с этими «невесомыми материями» и начинает борьбу Ломоносов. В своих сочинениях он доказывает, что и тепло и упругость газов можно понять, не пользуясь таинственными «материями».
Объяснение оказывается очень простым, если на помощь призвать атомное учение.
В XVIII веке атомное учение сделало значительный шаг вперед, стало конкретной научной гипотезой. М. В. Ломоносов был первым, кто связал представления об атомах с экспериментальными данными о составе и свойствах различных веществ. Атомная теория Ломоносова является органической частью всего его материалистического учения.
Ломоносов считал, что все тела состоят из мельчайших частиц, или, как он их называл,
«корпускул». Корпускулы чрезвычайно малы, и потому даже в небольшом количестве вещества их должно быть очень много. Но корпускулы — это еще не самые малые частицы вещества. Они состоят из еще более мелких частиц —
«элементов». Таким образом, корпускулы — это то, что мы теперь называем молекулами, а элементы — атомы.
Свойства тел и явления природы Ломоносов объясняет движением и взаимодействием частиц материи. Фактически основой его атомной теории стало положение о неразрывности материи и движения, в противоположность старой теории, считавшей движение чем-то внешним по отношению к атомам.
Сходных взглядов придерживался современник Ломоносова, талантливый швейцарский физик, член Петербургской Академии наук Даниил Бернулли. Однако большинством иностранных ученых идеи Ломоносова были встречены чрезвычайно враждебно. В 1754 году некий Арнольд для получения ученой степени в Эрлангенском университете (Германия) написал сочинение, в котором «с успехом доказал» неправильность объяснения теплоты, которое было дано Ломоносовым.
Но беспристрастный суд истории показал, что прав был Ломоносов: учение об атомах завоевало всеобщее признание.
Однако это произошло далеко не сразу.
Первоначально атомное учение прочно укрепилось в химии. Этому много способствовали труды английского ученого Джона Дальтона, который убедительно показал, какие замечательные перспективы открывает применение атомного учения в химии. Сложные законы химических превращений делались простыми и ясными, стоило только признать, что вещество состоит из мельчайших неделимых частиц. Атомное учение позволяло узнавать состав сложных соединений, сознательно искать пути получения новых веществ, предвидеть возможный результат химических превращений.
Атомное учение дало возможность не только объяснить открытые опытным путем законы, определяющие поведение вещества, но и предсказать новые явления и закономерности, до того неизвестные.
Однако и это не обеспечило признания реальности атомов. Еще во второй половине прошлого столетия идеалисты разных мастей всячески пытались помешать распространению атомного учения. Многие горе-теоретики утверждали, что атомы — это плод человеческой фантазии, а успехи атомной теории — это всего лишь случайная удача предположения, не имеющего под собою твердой почвы.
Только в результате длительной и напряженной борьбы, в которой атомное учение отстаивалось передовыми исследователями различных стран, оно сделалось общепризнанным.
В этой борьбе особенно велики заслуги английского физика К. Максвелла, немца Р. Клаузиуса, австрийского физика Л. Больцмана, польского ученого М. Смолуховского и недавно умершего друга Советского Союза француза Ж. Перрена.
Совместная работа лучших ученых мира подтвердила гениальную мысль Михаила Васильевича Ломоносова о том, что свойства тела определяются свойствами образующих его частиц, их расположением и движением.
Молекулы
Итак, все в мире состоит из мельчайших частиц, которые Ломоносов называл корпускулами, а мы называем молекулами.
Если делить крупинку сахара или каплю воды на все более и более мелкие части, то рано или поздно мы придем к предельно малой частице — молекуле. Молекула сохраняет еще свойства, присущие данному веществу: молекула воды сохраняет свойства воды, молекула сахара — свойства сахара.
Насколько малы молекулы и как много их в любом теле, можно видеть из такого примера. Представьте себе, что мы взяли стакан воды и при помощи особой краски переметили все находящиеся в нем молекулы воды. Выльем этот стакан воды с мечеными молекулами в океан и перемешаем воду равномерно между всеми океанами, морями и реками мира. Если теперь в любом месте зачерпнуть стакан воды, то в нем окажется около сотни знакомых нам меченых молекул.
Молекулы так малы, что трудно представить себе их состоящими из еще более мелких частиц. А между тем молекулы действительно состоят из еще более мелких частиц, которые теперь и называются атомами.
 Рис. 4. Если сложить вместе столько песчинок, сколько содержится молекул воздуха в одном кубическом сантиметре, то получится куча, которая закроет большой завод.
Рис. 4. Если сложить вместе столько песчинок, сколько содержится молекул воздуха в одном кубическом сантиметре, то получится куча, которая закроет большой завод.
Однако если разделить молекулы на атомы, то присущие данному веществу свойства будут потеряны. Молекула воды распадется на атом кислорода и два атома водорода. Водород и кислород — газы; по своим свойствам они совсем не похожи на воду.
Физические и химические свойства молекул зависят от того, из каких атомов состоит молекула. На рисунке 5 изображены молекулы веществ, знакомых нам из повседневной жизни.
 Рис. 5. Модели молекул: а — кислорода, б — углекислого газа, в — бензола.
Рис. 5. Модели молекул: а — кислорода, б — углекислого газа, в — бензола.
Молекула углекислого газа получается в результате соединения атома углерода с двумя атомами кислорода; в молекуле химического вещества, называемого бензолом, содержится шесть атомов углерода и шесть атомов водорода. Молекула кислорода состоит из двух одинаковых атомов кислорода. Встречаются молекулы более сложные, но есть и такие, которые состоят всего из одного атома.
Если заменить хотя бы один из атомов, входящих в молекулу, другим, свойства ее изменятся. Молекула воды состоит, например, из одного атома кислорода и двух атомов водорода (рис. 6).
 Рис. 6. Молекула воды.
Рис. 6. Молекула воды.
Если один из атомов водорода в молекуле воды заменить на атом металла натрия, то получится молекула вещества, называемого едким натрием, или едкой щелочью. Едкий натрий — твердое вещество, по своим свойствам совершенно непохожее на воду. Свойства молекул, однако, зависят не только от того, какие атомы входят в их состав, но и от того, как они расположены. В этом можно убедиться, рассмотрев две молекулы, изображенные на рисунке 7.
 Рис. 7. Две молекулы, различающиеся расположением атомов.
Рис. 7. Две молекулы, различающиеся расположением атомов.
Каждая из них содержит 4 атома углерода и 10 атомов водорода, но свойства этих молекул различны.
Причиной тому — разное расположение атомов.
Атомы в молекулах располагаются не как угодно. Их размещение подчиняется определенным законам. В приведенном примере возможны только два расположения атомов, а следовательно, только две различные молекулы с одним и тем же составом. При увеличении числа атомов в молекуле количество возможных расположений их быстро возрастает; так, у молекулы, состоящей из 13 атомов углерода и 28 атомов водорода, возможны уже 802 различных расположения атомов, и, следовательно, у вещества с таким составом мыслимы 802 различные молекулы.
В этой книжке будет рассказано о таких свойствах и превращениях тел, при которых состав молекул остается неизменным. Поэтому мы в дальнейшем изложении для простоты условно будем считать молекулы очень маленькими твердыми шариками с определенными, неизменными свойствами, не задумываясь о том, как в действительности они устроены.
Несмотря на то, что молекулы нельзя было увидеть даже в самый сильный из обычных микроскопов, ученые нашли способы с полной достоверностью доказать их существование. А в недавнее время удалось построить замечательный прибор — электронный микроскоп, который увеличивает настолько сильно, что с его помощью можно увидеть и отдельные молекулы. На рисунке 8 изображена сделанная при помощи электронного микроскопа фотография одного сложного химического соединения. Правда, такие молекулы являются гигантами в мире молекул. Обычные же молекулы настолько малы, что и в электронный микроскоп мы не можем их увидеть.
 Рис. 8. Электронный микроскоп и полученная с его помощью фотография молекул одного сложного химического соединения.
Рис. 8. Электронный микроскоп и полученная с его помощью фотография молекул одного сложного химического соединения.
Вечное движение
Каковы же свойства молекул?
«Первым и самым важным из прирожденных свойств материи является движение», — писали около ста лет назад Маркс и Энгельс. Молекулы не находятся в покое, а непрестанно движутся.
Очевидно, и частицы воздуха, беспорядочно двигаясь, непрерывно ударяются о нас, как бы обстреливают наши тела. Почему же мы не чувствуем этих ударов? Объясняется это очень просто. Молекулы, как мы знаем, чрезвычайно малы и легки, и наши органы чувств не воспринимают слабых ударов отдельных молекул. Не чувствуем же мы увеличения тяжести надетой на голову шляпы, когда на нее сядет комар. А комар состоит из многих миллиардов молекул!
Другое дело, если быстро движущаяся молекула ударяется об очень маленькую частицу, по размерам сравнимую с ней. В этом случае удар уже не пройдет бесследно для частицы.
Каждый из вас не раз наблюдал, конечно, как солнечный луч, попадая в темную комнату через щель ставни или неплотно задернутую штору, пронизывает воздух и делает видимым множество находящихся в нем мельчайших пылинок. Какое беспорядочное движение можно наблюдать при этом! Пылинки причудливо мечутся и кружатся, напоминая рой мошек в теплый летний вечер. Такое же беспорядочное движение можно увидеть, если, вооружившись микроскопом, присмотреться к частичкам дыма обычной папиросы. И такое же причудливое движение совершают мельчайшие частицы, если поместить их в жидкость. Сложные запутанные узоры выписывают, например, частицы цветочной пыльцы, высыпанной в воду.
Пылинки неутомимы в своем движении! Сколько бы времени вы ни наблюдали их — час, день, неделю, они с одинаковым усердием будут продолжать свою бесконечную пляску. В чем причина этого движения? Что заставляет частицы постоянно изменять свой путь, неожиданно бросаться в сторону, как будто наскочив на невидимое препятствие?
На первый взгляд ответ очень прост: ведь окружающий нас воздух никогда не бывает полностью спокоен. Даже когда нет ощутимого ветра, и тогда движутся навстречу друг другу и взаимно перемешиваются потоки теплого и холодного воздуха. Такие же тепловые потоки наблюдаются и в воде, нагретой в одном месте больше, чем в другом.
Не эти ли потоки, сталкиваясь друг с другом и взаимно перемешиваясь, заставляют пылинки двигаться? Ну что же, это можно проверить! Возьмем стакан с водой, к которой подмешана цветочная пыльца, обмотаем его ватой, чтобы защитить и от нагревания и от охлаждения, и поставим на стол вдали от окна. Пройдет несколько часов или, если хотите, дней, и вся жидкость сделается одинаково нагретой — тепловые потоки в ней исчезнут. Вероятно, и наши пылинки, не подгоняемые более, перестали двигаться? Но вооружимся микроскопом, и мы снова увидим, что среди пылинок царит прежнее оживление: как и раньше, они беспорядочно мечутся, гонимые какой-то неведомой силой.
Значит, не перемешивание жидкости или газа, вызванное разной нагретостью его отдельных слоев, причина движения пылинок. Поищем другое объяснение этого загадочного явления.
Не мы ли с вами сами являемся причиной этого движения? Ведь стакан, в котором мы наблюдаем движение, стоит на столе, и мы, двигаясь по комнате, закрывая и открывая двери, непрерывно сотрясаем стол. А когда мы неподвижны, это за нас делают проезжающие по улице автомобили, трамваи, автобусы.
Чтобы избежать каких бы то ни было сотрясений, ученые опускались в подземелья, где сосуд с жидкостью находился в полном покое. Но и это не могло успокоить пылинки, они двигались по-прежнему неутомимо!
Что же заставляет их двигаться?
Если присмотреться к нашему опыту, то в глаза бросится обстоятельство еще более странное, чем движение пылинок.
В самом деле, описанное явление можно наблюдать, подмешав к воде мельчайшие частицы любого вещества, нерастворимого в воде. Это вещество может быть и более тяжелым, чем вода. В последнем случае частицы должны были бы потонуть и собраться на дне стакана. Однако если мы проделаем такой опыт, например, с глиной, то убедимся, что часть частиц, вместо того чтобы упасть на дно стакана, расположится так, как это изображено на рисунке 9.
 Рис. 9. Так располагаются мельчайшие частички в сосуде с водой.
Рис. 9. Так располагаются мельчайшие частички в сосуде с водой.
Внизу их будет больше, наверху меньше. И такое расположение не меняется, сколько бы времени мы ни наблюдали!
Что же мешает частичкам упасть?
Оказывается, одна и та же причина заставляет частицы двигаться и не дает им упасть. Это удары о них молекул воды.
Конечно, причудливые движения каждой цветочной пылинки не есть результат ударов отдельных молекул. Дело в том, что в какое-либо мгновение об одну из сторон пылинки ударяется или значительно больше молекул, чем о противоположную, или же молекулы, движущиеся с большей скоростью. Все эти удары складываются и заставляют пылинки двигаться в том направлении, в каком перемещаются избыточные или особенно быстрые молекулы.
Описанное движение мельчайших пылинок было открыто известным, шотландским ботаником Броуном и названо по его имени
броуновским. А теория, объясняющая беспорядочное движение частиц под влиянием ударов молекул, была развита польским ученым М. Смолуховским.
Броуновское движение позволяет ученым обнаруживать движение молекул так же, как движение листвы деревьев позволяет заметить даже слабое дуновение ветерка.
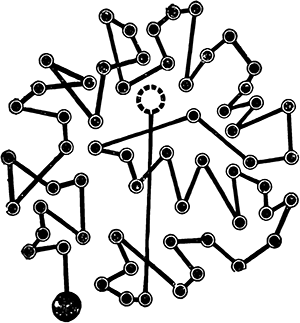 Рис. 10. Схема броуновского движения.
Рис. 10. Схема броуновского движения.
Со скоростью пули
В жизни мы привыкли чаще иметь дело с твердыми и жидкими телами и реже с газами. Поэтому первые нам представляются более простыми и понятными, чем неосязаемые и невидимые газы. Однако не все, к чему мы привыкли и что кажется нам простым и ясным, является в действительности простым. Оказывается, газы имеют более простое строение, чем жидкости или твердые тела; поведение молекул газов легче изучить и понять.
Если бы мы построили микроскоп, в который можно было бы видеть отдельные молекулы, и стали бы с его помощью рассматривать спокойный воздух или какой-либо газ, то обнаружили бы в «спокойном» воздухе или газе невообразимую сутолоку и суету. Молекулы газа движутся беспорядочно по всем направлениям с самыми различными скоростями. На первый взгляд здесь нет никакого порядка, никаких правил движения. Есть молекулы быстрые, есть и молекулы медленные; и те и другие движутся по всем направлениям. Однако если измерить скорости большого числа молекул, то окажется, что очень быстро и очень медленно движется совсем небольшая доля молекул.
Важный для науки закон, который указывает, как распределяются молекулы по скоростям (то-есть сколько молекул движется медленно, сколько — быстро), был найден английским физиком К. Максвеллом.
По этому закону подавляющее большинство молекул движется со скоростями, мало отличающимися друг от друга. Таким образом, без большой ошибки можно считать, что все молекулы движутся с одной и той же
средней скоростью.
Сказанное можно пояснить таким примером. Если собрать всех только что призванных в армию солдат одного года рождения, построить их рядами, так, чтобы в каждом ряду стояли солдаты одного роста, затем ряд самых высоких поставить справа, а самых низких слева, то окажется, что новобранцев очень высокого и очень маленького роста будет только несколько человек, а чем ближе к середине, тем длиннее будут ряды. Большинство призывников имеет близкий к среднему рост. Это правило будет оправдываться всегда, когда мы будем брать достаточно большое количество призывников. Если же мы захотим проверить сказанное, взяв десять-одиннадцать призывников, то можно случайно встретиться со значительными отклонениями от этого правила. Точно так же и замена различных скоростей молекул средней скоростью не будет приводить к ошибкам только в том случае, если молекул достаточно много, потому что тогда доля молекул со скоростями, значительно отличающимися от средней, будет невелика. Но даже в очень небольшом количестве газа, например в объеме, равном булавочной головке, содержится громадное число молекул, исчисляющееся цифрой с 16 нулями. Поэтому во всех практических случаях можно без существенной ошибки считать, что все молекулы движутся с одной и той же средней скоростью.
Какова же величина средней скорости движения молекул газа?
У разных газов она различна.
Самые быстрые молекулы — молекулы легкого газа водорода. Медленнее движутся молекулы кислорода. Еще медленнее — молекулы углекислоты, тяжелого газа, образующегося при многих химических превращениях и, в частности, при горении.
При обычной температуре молекула водорода пробегает около 2 километров в секунду, то-есть около 7 000 километров в час (рис. 11).
 Рис. 11. При обычных температурах молекулы водорода движутся быстрее самолета и поезда.
Рис. 11. При обычных температурах молекулы водорода движутся быстрее самолета и поезда.
Молекулы кислорода совершают за 1 секунду путь около 500 метров, то-есть около 1 800 километров в час. Скорость движения молекул углекислоты — 1 200 километров в час. Еще медленнее движутся молекулы некоторых сложных веществ; например, молекулы вещества, называемого карбонилом никеля, проходят за час меньше 600 километров. Такую молекулу легко обгонит современный самолет.
Эти цифры вызывают законное удивление. В самом деле, молекулы водорода, двигаясь беспрепятственно, облетели бы вокруг Земли по экватору всего за 6 часов. Даже медленная молекула углекислоты совершила бы это путешествие меньше чем за двое суток.
С другой стороны, мы знаем, как медленно распространяются запахи. Если на некотором расстоянии от нас разольют бензин, то для того, чтобы запах дошел до нас, необходимо некоторое время. Но ведь скорость распространения запаха — это и есть как будто скорость движения молекул пахучего вещества в воздухе. Как же примирить быстрое движение молекул, проходящих сотни метров в секунду, с медленным распространением запаха?
«Очевидно, что отдельные атомы воздуха, взаимно приблизившись, сталкиваются с ближайшими… вторые атомы друг от друга отпрыгнули, ударились в более близкие к ним и снова отскочили; таким образом, непрерывно отталкиваемые друг от друга частыми взаимными толчками, они стремятся рассеяться во все стороны», — писал М. В. Ломоносов.
Распространение одного газа в другом, вызванное беспорядочным движением молекул, называется диффузией. Теперь нам понятно, почему диффузия происходит медленно.
Соударение молекул! Вот в чем причина медленности диффузии. Хотя молекулы газов и движутся с очень большими скоростями, они проходят без соударения только очень короткие пути — миллионные доли сантиметра.
Соударения резко изменяют направление движения молекул и придают их путям причудливую, замысловатую форму.
Таким образом, двигаясь очень быстро, но непрерывно меняя направление своего движения, молекулы как бы «толкутся» на месте. В этом суетливом движении молекулы медленно перемещаются вперед.
Чем чаще происходят соударения, тем медленнее диффундирует газ. В окружающем нас воздухе соударения молекул происходят очень часто. Если бы мы попытались сосчитать удары, которые испытывает молекула только за одну секунду, и при этом условились тратить одну минуту на сосчитывание ста ударов, то для этого понадобилось бы около двухсот лет.
Молекулы, летящие со скоростью пули, бесчисленные соударения, причудливый узор пути, своеобразный закон распределения молекул по скоростям… Все это может заронить сомнение в реальности наших объяснений.
В науке установилось золотое правило — проверять опытом все предположения, как бы остроумны они ни были. Нет оснований делать исключение и для молекул. Надо измерить скорости движения мельчайших частиц, проверить, как распределяются эти скорости: какая доля молекул движется быстро, какая медленно.
Не фантазия ли это?
Однако как же измерить скорость движения молекул, если молекулы столь малы, что их нельзя рассмотреть даже в самый сильный микроскоп?
Вероятно, многие замечали, что стеклянный колпачок перегоревшей электрической лампочки часто бывает покрыт темным налетом. Отчего возникает этот налет?
Когда электрическая лампочка включена, металлический волосок, от которого исходит свет, сильно накален. От его поверхности непрерывно отрываются атомы металла. Оторвавшись, атомы разлетаются в разные стороны и, ударившись о стенку стеклянного колпачка, прилипают к ней. Так, волосок, теряя атомы, делается все тоньше и тоньше, а на стекле образуется постепенно утолщающийся слой осевших атомов. Когда слой осевших атомов сделается достаточно толстым, его можно будет различить глазом: мы увидим на стекле темный налет. Чем больше осядет атомов, тем темнее будет этот налет.
Волосок электрической лампочки делают из какого-либо тугоплавкого металла, например из вольфрама, у которого атомы с трудом отрываются от поверхности. Поэтому лампочка горит много часов, прежде чем на колпачке возникнет заметный налет. Изготовив волосок из легкоплавкого металла, можно получить темный налет очень быстро.
Этим явлением и
воспользовались ученые, для того чтобы измерить скорости движения атомов.
Если из стеклянного баллончика очень тщательно откачать воздух, то оторвавшиеся от металла атомы будут долетать до стенки, не ударяясь по пути о молекулы воздуха. В этом случае путь каждого атома будет известен: он будет начинаться на поверхности волоска и оканчиваться на стенке баллончика. Теперь, для того чтобы определить скорость движения атомов, достаточно узнать время, которое затрачивают атомы на свое путешествие.
Для решения этой задачи был построен специальный прибор.
Справа от накаленного волоска расположена ширма с узкой щелью, а за нею, на некотором расстоянии, экран. Ширма преграждает путь всем атомам, кроме тех, которые попадут в щель. За ширмой летящие атомы образуют узкий лучик. Осев на экране, они создадут несколько увеличенное темное изображение щели (рис. 12).
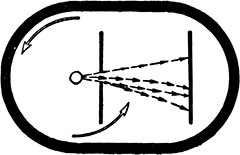 Рис. 12. Устройство прибора для определения скоростей молекул.
Рис. 12. Устройство прибора для определения скоростей молекул.
По существу, мы встречаемся здесь с тем же приемом, которым пользуются маляры при нанесении рисунка с помощью трафарета. Как известно, трафаретом называют пластинку, в которой сделано отверстие по форме желаемого рисунка. Приложив трафарет к стене, проводят по нему кистью с краской. Краска попадает на стену только в местах, соответствующих отверстиям в трафарете. Сняв трафарет, мы видим на стене рисунок.
В описываемом опыте роль кисти с краской играет пучок быстро летящих атомов.
В неподвижном приборе изображение щели приходится как раз напротив нее.
Предположим теперь, что прибор быстро вращается против часовой стрелки вокруг накаленного волоска. Каждый атом по-прежнему будет двигаться прямолинейно. Однако теперь за то время, которое требуется атому для того, чтобы, пройдя щель, долететь до экрана, весь прибор успеет слегка повернуться, и атом прилипнет к экрану не в том месте, где раньше, а несколько в стороне.
Если бы все атомы двигались с одинаковой скоростью, то изображение щели на экране, не изменившись по форме, сместилось бы на некоторое расстояние. Смещение было бы тем больше, чем медленнее двигались бы атомы и чем быстрее вращался бы прибор.
Зная число оборотов прибора в секунду, расстояние от щели до экрана и смещение изображения, можно вычислить скорость движения атомов.
Когда подобный опыт был произведен, то оказалось, что изображение щели не просто смещается, как только что описано, но одновременно со смещением размазывается (рис. 13).
 Рис. 13. Изображение щели на экране приборчика.
Рис. 13. Изображение щели на экране приборчика.
Причина этого ясна. Отдельные атомы движутся с разными скоростями. В пучке летящих атомов есть движущиеся быстро, есть и движущиеся медленно. Первые попадут на экран, сместившись немного, вторые — значительно. В результате вместо резкого изображения на экране появится размытая полоска. Присмотревшись к ней, мы заметим, что окраска полоски не одинакова. Ясно выступает более темная часть, на которую упало, очевидно, большее количество атомов. Все эти атомы двигались со скоростями, близкими друг к другу. Если какой-либо участок полоски в два раза темнее, чем другой, то это означает, что на него упало в два раза больше атомов, чем на тот, который светлее. А так как каждому участку полоски соответствует определенная скорость движения атомов, то, разделив полоску на отдельные участки и сравнивая их потемнение, ученые проверили, как распределяются скорости атомов.
Эти опыты полностью подтвердили правильность атомного учения.
Мы уверены теперь в том, что большая часть атомов или молекул движется со скоростями, не очень сильно, отличающимися от средней скорости.
Но от чего же зависит сама средняя скорость? Можно ли ее изменить: увеличить или уменьшить?
Что такое теплота?
В обыденной жизни мы различаем тела теплые и тела холодные. Но что же такое теплота?
«Очень хорошо известно, — говорил Ломоносов, — что теплота возбуждается движением: от взаимного трения руки согреваются, дерево загорается пламенем; при ударе кремня об огниво появляются искры; железо накаливается докрасна от проковывания частыми и сильными ударами, а если их прекратить, то теплота уменьшается…»
Движение молекул — вот истинное объяснение теплоты, вот что предложил Ломоносов вместо излюбленной в его время «невесомой материи теплоты»!
Новизна и революционность мысли Ломоносова вызвали яростные нападки со стороны большинства зарубежных ученых.
Наиболее талантливые современники поняли и оценили значение идей Ломоносова, но официальная зарубежная наука в лице академий и университетов их отвергла. Гениальный математик член Петербургской Академии наук Леонард Эйлер, которому Ломоносов послал свои сочинения, писал о его работах, что они «не токмо хороши, но и весьма превосходны, ибо он пишет о материях физических и химических, весьма нужных, которые поныне не знали и истолковать не могли самые остроумные люди… Желать должно, чтобы и другие Академии в состоянии были произвести такие откровения, какие показал г-н Ломоносов».
Часто о тепле и холоде мы судим по нашим ощущениям. Однако такое суждение очень неточно. В самом деле, когда мы заходим с мороза в комнату, даже плохо натопленную, нам кажется, что в ней тепло. Когда же мы утром встаем из теплой постели, в той же комнате нам кажется холодно.
Можно проделать еще такой опыт: взять три чашки, наполнить первую холодной водой, вторую теплой и третью горячей. Если теперь вы опустите правую руку в чашку с горячей водой, а левую в чашку с холодной и, подержав их там некоторое время, перенесете обе руки в чашку с теплой водой, то по ощущению правой руки вода в чашке будет холодной, а по ощущению левой руки горячей. Возникает затруднительное положение: какой из своих рук верить? Вот поэтому-то для суждения о том, насколько нагрето тело, лучше воспользоваться
термометром.
Обычный термометр представляет собою узкую трубочку, заканчивающуюся снизу шариком, наполненным какой-либо жидкостью. Чаще всего шарик термометра наполняют ртутью или спиртом; бывают термометры, наполненные и другими жидкостями.
При нагревании жидкость расширяется и поднимается по трубке. Чем больше нагрев, тем выше поднимается жидкость. Поместив сзади трубочки линейку с делениями, можно определять степень нагретости тела, или, как говорят,
измерять температуру в градусах.
Наиболее часто за нуль градусов принимают температуру тающего льда, а за 100 градусов температуру водяного пара около поверхности кипящей воды при нормальном атмосферном давлении (в одну атмосферу). Такой термометр называют термометром Цельсия. По этому термометру указывают температуру воздуха в сводках погоды, которые вы ежедневно слышите по радио.
Итак, мы говорим, что температура теплого тела выше, чем температура холодного. Сторонники «тепловой материи» объясняли эту разницу в температуре очень просто: в теплом теле «тепловой материи» больше, чем в холодном.
А как объяснить эту разницу с современной, или, если быть справедливыми, с ломоносовской, точки зрения?
Как вы уже знаете, можно без большой ошибки считать, что все молекулы в газе движутся с одной и той же средней скоростью. Если сравнить две порции одного и того же газа, взятые при разных температурах, то окажется, что средние скорости движения молекул в них будут различны. Чем выше температура газа, тем больше средняя скорость движения его молекул. Так, средняя скорость движения молекул кислорода, нагретого до 100 градусов тепла, будет почти в полтора раза больше, чем средняя скорость того же кислорода, охлажденного до 100 градусов мороза.
Вполне законно поэтому сказать, что температура газа является непосредственной мерой средней скорости движения его молекул. При этом, однако, надо помнить, что учитывается только средняя скорость беспорядочного движения молекул, только она определяет температуру.
Если взять бутылку, наполненную воздухом, и закрыть горлышко пробкой со вставленным в нее термометром, то можно, быстро двигая бутылку, придать всем молекулам, находящимся в ней, добавочную скорость. Однако, смотря время от времени на термометр, легко убедиться в том, что движение бутылки не вызывает повышения температуры. Это вполне понятно: ведь скорость беспорядочного движения молекул в нашем опыте не изменилась, а общее всем молекулам движение вместе с бутылкой на температуру не влияет.
Хорошо известно, что если привести в соприкосновение две порции одного и того же газа, одна из которых холодная, а другая горячая, то первая нагреется, а вторая остынет, и температура газа сделается всюду одинаковой.
Это объясняется тем, что более быстрые молекулы нагретого газа, ударяя медленные молекулы холодного, отдают им часть своей энергии и благодаря этому сами начинают двигаться медленнее, «ибо тело, движущее своей силой другое, столько же оной у себя теряет, сколько сообщает другому, которое от него движение получает», — писал Ломоносов.
Спустя некоторое время, в результате бесчисленных соударений, установится общая всем молекулам смеси средняя скорость. Она будет больше, чем у молекул холодной, но меньше, чем у молекул горячей порции газа, до их смешения, и именно она определит температуру смеси.
 Рис. 14. Температура различных тел. На центральном рисунке указана температура атомного взрыва.
Рис. 14. Температура различных тел. На центральном рисунке указана температура атомного взрыва.
У читателя, естественно, возникнет вопрос: а что произойдет в том случае, если привести в соприкосновение два разных газа, имеющих одинаковую температуру? Сравняются ли при этом средние скорости молекул обоих газов? Оказывается, что этого не произойдет.
Очевидно, что наше простое определение температуры требует уточнения.
Чтобы определить точно, что такое температура, придется начать издалека.
Всякое движущееся тело способно совершить работу, оно обладает, как говорят физики, кинетической энергией. Не составляют исключений и движущиеся молекулы газов, — они тоже обладают кинетической энергией.
Чем быстрее движется тело, тем больше его кинетическая энергия. Из двух тел, движущихся с одинаковой скоростью, кинетическая энергия больше у того, масса которого больше, которое тяжелее.
Вычислить кинетическую энергию тела несложно: для этого надо массу тела умножить на квадрат его скорости и полученный результат разделить пополам.
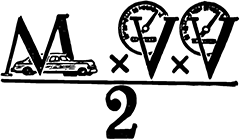 Рис. 15. Так измеряется кинетическая энергия тела. М — масса тела, V — его скорость.
Рис. 15. Так измеряется кинетическая энергия тела. М — масса тела, V — его скорость.
Как показывают точные вычисления, температура тела является мерой средней кинетической энергии поступательного движения его молекул.
При одинаковой температуре средние кинетические энергии поступательного движения молекул всех газов равны. Понятно, что при этом более тяжелые молекулы движутся медленнее, более легкие быстрее. Если массы молекул различаются весьма значительно, то может оказаться, что средняя скорость молекул более холодного газа больше, чем у газа теплого. Для этого, конечно, необходимо, чтобы масса молекул холодного газа была много меньше массы молекул газа теплого.
Зная, от чего зависит температура газа, можно сделать два важных заключения.
Повышая температуру газа, мы повышаем скорость движения его частиц, и поскольку скорость можно увеличивать до очень больших значений, постольку возможны, очевидно, и очень высокие температуры. Известно, что астрономы предполагают внутри звезд температуры, исчисляемые миллионами градусов.
С другой стороны, то же самое движение, как писал Ломоносов, может настолько уменьшиться, что никакое дальнейшее уменьшение движения будет невозможно. И Ломоносов совершенно правильно заключил, что «по необходимости должна существовать наибольшая и последняя степень холода…»
Следовательно, нельзя безгранично охлаждать газ. Рано или поздно мы достигнем такой его температуры, когда скорость теплового движения молекул уменьшится до нуля. Дальнейшее охлаждение станет невозможным. Как оказалось, на 273,23 градуса ниже нуля надо охладить газ для того, чтобы прекратилось беспорядочное тепловое движение его молекул. Температуру, которая на 273,23 градуса ниже обычного нуля, называют
абсолютным нулем.
Не думайте, однако, что при абсолютном нуле полностью исчезнет движение, — это прирожденное свойство материи. Нет.
Исчезнет только тепловое движение, а сохранившееся движение частиц уже не будет зависеть от температуры.
Свойства веществ при очень низких температурах сильно изменяются. Так, при температуре около минус 200 градусов резиновый мячик делается хрупким, как стеклянный шарик; как серебряный, звенит при этой температуре свинцовый колокольчик.
Теплоемкость
Для того чтобы вскипятить чай, чайник ставят на плиту. Никто никогда не наблюдал, чтобы чайник, стоящий на столе, согрелся сам собой.
Мы говорим: для того чтобы тело нагрелось, то-есть для того чтобы повысилась его температура, ему необходимо сообщить какое-то количество теплоты. Эту теплоту можно получить различными способами. Обычно ее получают или сжигая топливо — дрова, керосин, газ, — или пропуская электрический ток через специальный нагреватель.
Чем больше теплоты мы сообщим телу, тем выше поднимется его температура.
Однако если одно и то же количество теплоты сообщать разным телам, то повышение температуры у них будет различно. Все это можно объяснить, если правильно определять, что такое температура, если опираться в своих рассуждениях на атомное учение.
Когда телу сообщается какое-то количество теплоты, средняя кинетическая энергия его молекул возрастает и, следовательно, повышается температура.
Один из основных законов природы — закон сохранения и превращения энергии — утверждает, что энергия не может создаваться из ничего; следовательно, без сообщения телу энергии температура его не поднимется.
Если одно и то же количество теплоты сообщить поочередно двум различным телам, одно из которых содержит молекул значительно больше, чем другое, то в первом случае теплота распределится между большим числом молекул, так что на долю каждой из них придется меньшее количество теплоты, и средняя кинетическая энергия молекул возрастет меньше, чем во втором случае. Другими словами, если в теле, которому сообщают теплоту, молекул много, температура возрастет незначительно. Наоборот, если молекул мало, то подъем температуры велик.
Обычно количество вещества измеряют в граммах. В одном грамме различных газов содержится разное число молекул, а потому для одинакового повышения их температуры необходимо разное количество теплоты.
Количество теплоты, необходимое для нагревания 1 грамма какого-либо вещества на 1 градус, условились называть удельной теплоемкостью этого вещества.
Удельную теплоемкость воды приняли равной единице.
Количество теплоты, необходимое для нагрева 1 грамма воды на 1 градус, назвали малой калорией. Это и есть единица измерения количества теплоты. Тысячу малых калорий называют большой калорией, или килограмм-калорией.
При сгорании различных веществ выделяется разное количество теплоты. Все знают, что если топить печь каменным углем, то тепла будет больше, чем если ту же печь топить дровами. Это и понятно, потому что при сгорании одного грамма древесины выделяется от 4 000 до 4 800 калорий, а при сгорании одного грамма каменного угля — от 7 000 до 8 000 калорий, то-есть почти в два раза больше.
Особенно много теплоты выделяется при ядерных превращениях, которые происходят в атомном котле или атомной бомбе. При расщеплении 1 килограмма урана в атомном котле выделяется столько же теплоты, сколько при сгорании 20 000 тонн угля! Это поистине огромное количество теплоты. Атомная силовая станция мощностью в 100 000 лошадиных сил потребляет в день всего от 75 до 350 граммов урана!
Удельная теплоемкость газа зависит не только от массы его молекул, но и от их строения. Это легко пояснить.
Молекула, состоящая из одного атома, может только перемещаться. Атом настолько мал, что не имеет смысла говорить о его вращении.
Напротив, когда мы имеем дело с молекулой, состоящей из двух атомов, игнорировать ее вращение нельзя. Кинетическая энергия двухатомной молекулы будет уже складываться из кинетической энергии поступательного движения и кинетической энергии вращения. Поэтому теплоемкость двухатомных газов, при одной и той же массе молекул, будет больше, чем одноатомных, а трехатомных — больше, чем двухатомных.
Изучение теплоемкости различных веществ играет большую роль в процессе познания строения вещества. Измеряя теплоемкость тел, можно выяснить характер движения, которое совершают мельчайшие частицы вещества — атомы и молекулы. Измеряя теплоемкость какого-либо тела в различных условиях, можно проникнуть в тайны строения вещества.
Молекулярная артиллерия
Газы и пары играют важную роль в различных машинах. Водяной пар толкает поршень в цилиндрах паровых машин, приводит в быстрое движение колеса турбин. Газы, образующиеся при сгорании топлива, заставляют работать различные двигатели внутреннего сгораний, приводя в движение автомобили, тракторы, самолеты. Вылетающие из реактивного двигателя газы сообщают большие скорости реактивным самолетам. Газы, получающиеся при взрыве пороха, придают огромные скорости снарядам различных орудий.
Для того чтобы строить хорошие турбины, паровозы, тракторы, мощные пушки, самолеты, — всюду необходимо знание свойств газов. Понять и объяснить свойства газов позволяет движение молекул. Знание законов их движения дает возможность предвидеть поведение газов в различных условиях.
Разберемся в этом.
Если уменьшать объем, занимаемый каким-либо газом, газ оказывает этому сопротивление. Совершенно отчетливо сопротивление газа можно ощущать при накачивании воздухом велосипедной шины.
Сопротивление газа сжатию называют
упругостью. Упругость — одно из основных свойств всех газов.
Как объяснить упругость, в чем ее причина?
Попробуем ответить на этот вопрос, пользуясь нашими знаниями о строении газов. Представим себе такой опыт. У обычных весов, на которых взвешивают хлеб, одна чашка плоская, а другая в виде тарелки. Выставим весы на дождь и над вогнутой чашкой устроим навес так, чтобы дождевые капли на нее не попадали (рис. 16).
 Рис. 16. Дождь давит на открытую чашку весов с силой, которую можно измерить.
Рис. 16. Дождь давит на открытую чашку весов с силой, которую можно измерить.
Дождевые капли будут ударяться об открытую плоскую чашку весов и стекать с нее. Удары отдельных капель, складываясь, заставят чашку весов опуститься. Чтобы привести весы в равновесие, надо положить на вторую чашку гири. Уравновесив весы и подсчитав вес положенных гирь, мы определим силу, с которой дождь давит на открытую чашку весов.
Если теперь заменить плоскую чашку чашкой того же веса, но больших размеров, то для уравновешивания весов понадобится и больше гирь. Следовательно, один и тот же дождь давит на большую чашку весов с большей силой. Поэтому если мы хотим указанным способом охарактеризовать силу, с которой давят падающие капли дождя, то необходимо условиться, каких размеров следует брать плоскую чашку. Проще всего принять поверхность такой условной чашки равной одному квадратному сантиметру.
Если для поддержания весов в равновесии в описанном опыте пришлось положить на закрытую чашку 400 граммов, а поверхность открытой чашки была 20х20=400 квадратных сантиметров, то, значит, дождь давил на чашку с силой, равной 400 г:400 см
2, то-есть с силой в 1 грамм на каждый квадратный сантиметр поверхности чашки.
Силу, приходящуюся на единицу поверхности, называют
давлением, и можно сказать, что давление дождя в описанном опыте равнялось 1 грамму на квадратный сантиметр поверхности.
Какое же отношение имеет сказанное к свойствам газов? Самое непосредственное!
Мы знаем, что молекулы газов беспорядочно движутся со скоростями, близкими к скорости полета пули. При движении молекулы сталкиваются со своими соседями и ударяются о стенки сосуда, в который заключен газ. Если наполнить бутылку обычным, не сжатым воздухом, то число ударов, которое испытывает каждый квадратный сантиметр поверхности бутылки в 1 секунду, выразится цифрой с 22 нулями. Это очень большое число. Если бы такое число просяных зерен положить рядышком одно к другому, то можно было бы сто раз протянуть эту дорожку из зернышек до одной из ближайших звезд и обратно.
Таким образом, на стенки бутылки непрерывно падает чрезвычайно частый дождь мельчайших «капелек» вещества — молекул. Частицы газа как бы бомбардируют стенки сосуда.
Удары отдельных молекул так слабы, что не отмечаются ни приборами, ни нашими органами чувств, но они так часто следуют друг за другом, что, сливаясь вместе, производят давление, которое уже нетрудно измерить приборами или ощутить непосредственно.
От чего зависит давление газа?
Очевидно, что чем больше молекул ударится в единицу времени о какую-либо поверхность, тем большее давление будет сна испытывать. Кроме того, давление зависит от скорости движения молекул газа. Чем быстрее движутся молекулы, тем сильнее они ударяются о поверхность и тем больше будет производимое ими давление.
А что же происходит при сжатии газа?
Уменьшив объем, занимаемый тазом, в два раза, мы тем самым в два раза увеличим число молекул в каждом кубическом сантиметре, а значит, в два раза увеличим и число ударов о стенки сосуда в каждую секунду.
Если сжимать газ при постоянной температуре, то скорость молекул не изменяется: они ударяют о стенки с прежней силой, только чаще. Так, в нашем примере после уменьшения объема газа молекулы будут ударять о стенки в два раза чаще, и, значит, в два раза возрастет давление газа.
При очень сильном сжатии газ может сильно нагреваться. Кто знаком с работой дизельного мотора, тот знает, что в цилиндрах этой машины нет никаких «свечей» или каких-либо других средств зажигания. Поршень, сжимая газ в цилиндре, заполненном горючей смесью, сообщает ее молекулам такую скорость, что смесь разогревается до температуры вспышки. Воспламенившись, смесь быстро сгорает. Температура продуктов горения поднимается при этом еще выше, давление в цилиндре увеличивается, и поршень отбрасывается назад.
Вспомните, что, накачивая велосипедную шину, вы ощущаете, как нагревается насос. Многие скажут, что он нагревается благодаря трению поршня о стенки насоса. Это не совсем верно. Качайте этим же насосом воздух не в шину, а просто в атмосферу. Если насос при этом и нагреется, то слабее, чем в первый раз. Главная причина нагревания насоса заключается опять-таки в том, что, быстро сжимая газ, вы увеличиваете среднюю скорость его молекул, или, другими словами, повышаете его температуру.
При расширении сжатых газов наблюдается обратная картина — они охлаждаются.
Давление быстро растет при нагревании газов. Как это объяснить?
Вы уже знаете, что при нагревании газа скорости молекул увеличиваются. Быстрее двигаясь, молекулы чаще ударяются о стенки, и каждый удар их сильнее, чем при низкой температуре. Понятно, что возникающее от сложения ударов отдельных молекул давление газа в этом случае будет значительно больше.
Такова причина упругости газов. Впервые указал на нее М. В. Ломоносов.
«… Мы считаем излишним, — писал Ломоносов, — призывать на помощь для отыскания причины упругости воздуха ту своеобразную блуждающую жидкость, которую очень многие — по обычаю века, изобилующего тонкими материями, — применяют обыкновенно для объяснения природных явлений. Мы довольствуемся тонкостью и подвижностью самого воздуха и ищем причину упругости в самой материи его».
Жидкие газы
Сжимая какой-либо газ, мы уменьшаем расстояние между его молекулами. Увеличивая давление, можно очень сильно сблизить молекулы газа.
Известно, что вещество в жидком состоянии занимает меньший объем, чем в парообразном. Объем одного стакана воды, например, — 0,2 литра. То же количество воды в виде водяного пара займет объем приблизительно в полторы тысячи раз больший.
Невольно возникает вопрос: что же будет, если мы, увеличивая давление, сблизим молекулы газа до тех расстояний, на которых находятся друг от друга молекулы жидкостей? Не превратится ли газ в жидкость?
Этот вопрос давно привлекал внимание ученых. Более ста лет тому назад, в 1823 году, им занялся молодой английский физик М. Фарадей. Он производил много опытов, настойчиво добиваясь ответа на интересующий его вопрос.
Однажды, когда Фарадей ставил очередной опыт, пытаясь превратить в жидкость удушающий газ хлор, в лабораторию вошел его руководитель вместе с одним из своих приятелей. Последний, заметив на стенках прибора маслянистую жидкость и думая, что прибор загрязнен каким-то маслом по небрежности Фарадея, сделал ученому замечание. На следующее утро почтальон принес ему письмо молодого физика. Письмо было кратким: «Масло, замеченное вами вчера, было не чем иным, как жидким хлором».
Что же происходит при сжатии газа? Почему газ превращается в жидкость?
До сих пор при рассмотрении свойств мельчайших частиц вещества — атомов и молекул — мы умалчивали об одном важном их свойстве. Атомы и молекулы любого вещества притягиваются друг к другу особыми силами — силами молекулярного сцепления, подобно тому, как все тела притягиваются к земле силой тяготения. Пока расстояния между молекулами велики, силы молекулярного сцепления малы. Однако они быстро растут по мере того, как это расстояние уменьшается. Таким образом, при сжатии газа силы сцепления молекул друг с другом возрастают. Этих сил и оказывается достаточно для того, чтобы при комнатной температуре, когда молекулы газа еще быстро движутся, превратить в жидкость многие газы.
Так были получены жидкие газы: хлор, аммиак, углекислота и другие.
 Рис. 17. Если литр воды обратить в пар, то пар при температуре кипения воды и атмосферном давлении займет цистерну объемом в 1 500 литров.
Рис. 17. Если литр воды обратить в пар, то пар при температуре кипения воды и атмосферном давлении займет цистерну объемом в 1 500 литров.
Однако не все газы удается превратить в жидкость при комнатной температуре. Имеется много газов, которые при обычной температуре не сжижаются, какое бы высокое давление вы ни применили. К таким газам относятся кислород, азот, водород и т. д. Для них было придумано даже специальное название — «постоянные» газы. Так называли эти газы, желая подчеркнуть невозможность превращения их в жидкость.
В чем же причина загадочного «постоянства» кислорода, азота и других несжижающихся газов?
Правильный ответ на этот вопрос дал великий русский ученый Дмитрий Иванович Менделеев. Он рассуждал так: когда сжимается какой-нибудь газ, силы молекулярного сцепления помогают сжатию, стараются еще сильнее сблизить молекулы друг с другом. Этому сближению, однако, противится тепловое движение молекул, которое заставляет молекулы рассеиваться во все стороны, вызывает в газе стремление расшириться и занять возможно больший объем.
Если силы сцепления велики, они могут преодолеть стремление газа к расширению, удержать молекулы друг около друга и таким образом создать некоторый порядок в их расположении, характерный для жидкости.
Но когда силы сцепления невелики, тепловое движение молекул не позволит газу превратиться в жидкость, силы сцепления не смогут преодолеть стремления молекул улететь друг от друга возможно дальше. В этом и заключается причина «постоянства» таких газов, как кислород, азот или водород. Встречаем ли мы здесь непреодолимое препятствие, поставленное природой на пути человека? Отнюдь нет!
Для того чтобы превратить в жидкость «постоянные» газы, необходимо лишь сильно охладить их. При понижении температуры скорость движения молекул уменьшается, делается меньше стремление их рассеяться в разные стороны, и сил сцепления оказывается достаточно для сжижения газа.
Д. И. Менделеев указал, что для каждого газа существует определенная температура, выше которой его никаким давлением нельзя превратить в жидкость. При более высокой температуре жидкость существовать не может. Менделеев назвал эту температуру «температурой абсолютного кипения».
В наше время ее называют
«критической температурой» вещества.
Критические температуры различных веществ сильно отличаются друг от друга. Так, водяной пар нельзя превратить в воду, если он нагрет выше 374 градусов, кислород же нельзя превратить в жидкость, если он не охлажден до 119 градусов ниже нуля.
Теперь понятно, почему так долго не могли превратить «постоянные» газы в жидкости. Температуры этих газов были выше их критических температур. Когда одновременно со сжатием начали сильно охлаждать газы до температур ниже критической, то все известные газы были превращены в жидкость и само название «постоянные» газы потеряло смысл.
В наше время в школах можно часто видеть голубую подвижную жидкость, налитую в небольшой сосуд с двойными стенками, посеребренными изнутри. Это жидкий воздух. Самый обыкновенный воздух, который окружает нас и которым мы дышим, превращенный в жидкость.
Жидкий воздух и жидкий кислород имеют огромное значение для промышленности. С помощью жидких газов можно получить воздух, обогащенный кислородом, а применение кислородного дутья увеличивает производительность доменных печей больше чем в два раза. Велико значение кислорода при газификации топлива, в частности при подземной газификации углей. Кислород необходим для повышения производительности сернокислотных заводов, для получения крепкой азотной кислоты и т. д.
Большое значение для народного хозяйства имеет сжижение и других газов, например аммиака, хлора, углекислоты.
Если газ достаточно охлажден, то нет необходимости применять для его сжижения особенно большое давление. Так, при критических температурах водород становится жидким уже при давлении в 12,8 атмосферы, кислород — при 50,8 атмосферы.
Чем сильнее охлажден газ, тем меньшее давление требуется для его сжижения. Вспомните, как легко превращается пар в воду на холодных предметах, внесенных в комнату, или на стеклах окна в зимнее время. Незначительное понижение температуры воздуха летней ночью вызывает уже появление росы.
Сжижение газа является ярким доказательством наличия сил молекулярного сцепления.
Жидкости, в основном вода, играют огромную роль в жизни природы, в промышленности и технике, в сельском хозяйстве. Объяснение свойств жидкостей — одна из главнейших задач науки о строении вещества.
II
НА ПУТИ К ПОРЯДКУ
Колыбель жизни
В далекие времена, когда на Земле не было еще ни растений, ни животных, ее поверхность почти сплошь покрывали первичные моря и океаны. Именно в их теплых водах происходило образование сложных органических веществ, приведших к возникновению жизни на Земле.
Видя на каждом шагу, какую огромную роль играет вода в жизни природы и человека, древние народы обожествляли воду.
Значение воды действительно огромно. Она обеспечивает плодородие почвы: участвует в самом процессе ее образования, несет питательные вещества растениям, делает возможным протекание сложных физико-химических и микробиологических процессов,
с которыми связана жизнь растений.
Всем известно, каким бедствием для сельского хозяйства может явиться засуха.
В наше время водою покрыто более семи десятых поверхности Земли, что составляет 361 миллион квадратных километров. Если бы всю воду морей и океанов равномерно распределить по поверхности Земли, то она покрыла бы Землю слоем почти в четыре километра толщиною.
Ежегодно с поверхности морей и суши испаряется 511 тысяч кубических километров воды! Попав в более высокие части атмосферы, эта огромная масса водяных паров вновь превращается в воду и падает на Землю в виде дождя, снега или града.
В вечном круговороте вода изменяет облик Земли. Спускающиеся с гор ледники вырывают на склонах глубокие долины и несут в океан огромные камни, куски скал…
Речные потоки ежегодно уносят в моря и океаны около 16 миллиардов тонн твердых материалов или в виде камней, различных обломков, или же в виде растворенных веществ. Попробуйте погрузить все это в товарные вагоны, и вы получите поезд, который тридцать раз опояшет земной экватор.
Унесенные реками обломки камней, песок, глина и прочее оседают на дно и дают начало образованию новых горных пород.
Не будет преувеличением, если мы скажем, что вода — главный природный фактор, определяющий геологические процессы, протекающие на Земле.
И человеческий организм и организм животного больше чем наполовину состоят из воды. Это может показаться неожиданным, но это так. Если животное потеряет всего от одной десятой до одной пятой части той воды, которая содержится в его организме, оно погибнет. Человек может прожить больше месяца без пищи, но умирает через несколько дней без воды.
Огромна роль воды в технике. Это она, превращенная в пар, заставляет работать паровые машины, турбины электростанций; это она, двигаясь по отопительным трубам, несет тепло в наше жилище; это она в виде быстрой струи помогает извлекать торф, намывает плотины; это она необходимый спутник самых разнообразных химических процессов.
Велика роль в жизни человека и других жидкостей. В химической промышленности в подавляющем большинстве случаев приходится иметь дело с жидкостями. Различные сорта нефти, бензины, масла, спирты, кислоты и многие другие вещества, с которыми встречается в своей практике химик, — жидкости.
Еще алхимики, как бы подводя итог своим бесчисленным опытам, утверждали, что «тела не действуют, если они не растворены».
Каково же строение жидкостей, чем их свойства отличаются от свойств газов и как объяснить особенности жидкостей, опираясь на учение об атомах?
Двуликий Янус
На старинных римских монетах можно встретить странное изображение — человеческую голову с двумя смотрящими в противоположные стороны лицами. Это языческий бог — двуликий Янус. Если один лик Януса обращен направо, то второй смотрит налево.
По своим свойствам жидкости напоминают это забытое божество. Если одни свойства их сходны со свойствами газов, то другие — со свойствами твердых тел.
Промежуточное положение, которое занимают жидкости между газами и твердыми телами, сильно затрудняет объяснение особенностей их атомного строения.
Те свойства, которые общи жидкостям и газам, скорее бросаются в глаза человеку, нежели те, которые указывают на родство жидкостей и твердых тел.
Особенно большое впечатление производит общая газам и жидкостям подвижность их частиц друг относительно друга.
Махните рукой!
Вы почти не ощущаете сопротивления воздуха.
Проведите рукой в воде!
Сопротивление более ощутимо, но все же рука свободно движется, увлекая за собой частицы воды. В этом отношении вода напоминает очень плотный газ и вовсе не похожа на твердое тело.
Кроме того, у жидкости, как и у газа, свойства одинаковы в любом направлении. Так, например, жидкость преломляет световой луч одинаково, вне зависимости от того, как он падает на ее поверхность. Иначе ведет себя кристаллическое твердое тело: преломление луча в нем зависит от того, как луч направлен.
И, наконец, как мы уже знаем, постепенно сжимая газ, его можно превратить в жидкость плавно, без скачкообразного изменения свойств вещества.
Все это, казалось бы, говорит о том, что жидкость можно считать очень сильно сжатым газом.
Не будем, однако, торопиться с выводами и продолжим сравнение свойств жидкостей, газов и твердых тел.
Каждый, кто хоть раз играл в футбол, знает, что перед началом игры кто-нибудь из футболистов проверяет, хорошо ли накачан мяч. Если мяч мягкий, в него насосом дополнительно накачивают воздух. Это можно сделать только потому, что воздух, как и другие газы, легко сжимается.
Совсем иначе ведут себя жидкости: они практически несжимаемы и в этом отношении гораздо больше походят на твердые тела, чем на газы.
Однажды был произведен такой опыт: в стальной сосуд налили ртуть и очень сильно сжали. На поверхности сосуда при этом появились мельчайшие капельки ртути, которая просочилась через толщу металла. Вот как велико было сопротивление ртути сжатию!
 Рис. 18. Для того чтобы сжать воду в стакане только на 4 процента, на нее нужно давить с силой в несколько десятков тонн.
Рис. 18. Для того чтобы сжать воду в стакане только на 4 процента, на нее нужно давить с силой в несколько десятков тонн.
Сходно ведут себя и другие жидкости. Чтобы, сжимая, уменьшить объем воды всего на 4 процента, ее надо подвергнуть давлению приблизительно в тысячу атмосфер.
Именно поэтому водой пользуются при испытании прочности водопроводных труб, артиллерийских снарядов, баллонов для сжатых газов и т. п. Испытуемый снаряд или баллон наполняют водой и, увеличивая давление, следят за тем, не образуется ли трещина, не появится ли на поверхности вода…
Если сравнивать различные тела по их сжимаемости, то жидкости надо было бы отнести в одну группу с твердыми телами, а не с газами.
К тому же заключению о сходстве твердых и жидких тел приводит сравнение их плотности.
Плотность различных веществ в газообразном состоянии обычно в тысячи раз меньше, чем их плотность в жидком состоянии. Другими словами, при испарении объем, занимаемый веществом, увеличивается в тысячи раз.
Иная картина наблюдается при плавлении, то-есть при превращении твердого тела в жидкость. Увеличение объема при этом невелико, оно составляет приблизительно десятую часть объема, занимаемого твердым телом.
В некоторых, правда немногочисленных, случаях при плавлении объем, занимаемый телом, даже уменьшается, так что плотность жидкости оказывается большей, чем плотность твердого тела. К таким необычным по изменению плотности веществам относятся вода, чугун, висмут.
Раз объем тел при плавлении изменяется незначительно, незначительно изменяются и расстояния между молекулами, а следовательно, и силы, действующие между ними.
Можно предположить поэтому, что движение мельчайших частиц вещества в жидкостях напоминает движение частиц в твердых телах, а не в газах. Это предположение нетрудно проверить. От характера движения частиц зависит теплоемкость вещества. Сравнив теплоемкость жидких и твердых тел, ученые убедились в том, что они действительно близки друг к другу, то-есть что движение мельчайших частиц жидкости напоминает движение атомов твердых тел, а не молекул газов.
Мы видим, что поступили правильно, не сделав поспешного вывода о родстве жидкостей и газов.
Если подвижность частиц и одинаковость свойств во всех направлениях роднят жидкости с газами, то плотность, теплоемкость и малая сжимаемость их указывают на сходство жидкостей и твердых тел.
Заметим, что если жидкость заставить быстро изменять форму, то она приобретает еще одну черту, роднящую ее с твердыми телами, а именно — делается хрупкой.
Мы привыкли к тому, что быть хрупкими, то-есть способными разламываться, могут только твердые тела. Оказывается, это неверно: при очень быстром ударе жидкость разламывается, как хрупкое твердое тело.
На рисунке 19 вы видите струю очень вязкой жидкости, которую пересекает медленно движущаяся палочка.
 Рис. 19. При медленном движении палочки струя вязкой жидкости изгибается.
Рис. 19. При медленном движении палочки струя вязкой жидкости изгибается.
Видно, как под давлением палочки струя изогнулась, в следующее мгновение она разорвется — палочка ее пересечет. Не то будет, если палочка ударит по струе достаточно быстро. В этом случае (рис. 20) струя разломается, как если бы она была сделана из стекла.
 Рис. 20. При быстром ударе струя разламывается, как хрупкое тело.
Рис. 20. При быстром ударе струя разламывается, как хрупкое тело.
На рисунке хорошо видны «осколки» жидкости, отброшенные при ударе.
Итак, мы убедились в том, что привычная нам текучесть жидкостей не является непреодолимым барьером между жидкостями и твердыми телами. При определенных условиях жидкость может быть хрупкой.
Чему же отдать предпочтение? Если на одну чашку весов положить свойства, роднящие жидкости с твердыми телами, а на другую — роднящие с газами, какая из чашек перетянет?
Оказывается, что ответить на этот вопрос нельзя, и вот почему.
Свойства жидкости сильно изменяются при изменении температуры. При низкой температуре, близкой к той, при которой жидкость затвердевает, свойства жидкости ближе к свойствам твердого тела. По мере же повышения температуры жидкость все более походит на газ, поведение мельчайших частиц, образующих жидкость, приближается к поведению молекул газа.
Кочующие маятнички
Каково же молекулярное строение жидкости?
Молекулы газа или пара движутся по причудливо изломанным линиям. Отдельные участочки этих линий много больше размеров самих молекул.
В жидкости положение иное.
Молекулы жидкости располагаются очень близко друг к другу. Поэтому их движение напоминает скорее дрожание, при котором они только незначительно смещаются, постоянно возвращаемые назад ударами соседних молекул. Сравнительно редко какой-нибудь молекуле удается вырваться из тесного окружения своих соседей. Большую же часть времени она движется как бы в клеточке, стенки которой образуют ближайшие к ней частицы.
Движение молекулы в этой ячейке напоминает движение маятника стенных часов-ходиков. Такое
движение называют колебательным.
Имеется, однако, существенное отличие колебаний, совершаемых маятником часов, от колебаний молекул жидкости. При колебании маятника подвес его остается неподвижным и только диск отклоняется попеременно то вправо, то влево. Уподобляя движения молекулы жидкости колебаниям маятника, необходимо предположить, что и подвес маятника, вместо «оседлого» образа жизни, то и дело кочует с одного места на другое. В течение периода «оседлой жизни» молекула колеблется внутри ячейки. В период «кочевья» она перебирается в соседнюю ячейку. За время, которое частица проводит в какой-либо ячейке, она успевает совершить большое число колебаний.
Однако если температура жидкости будет увеличиваться, молекулы станут все чаще и чаще кочевать из одной ячейки в другую. Тем самым время их «оседлой жизни» уменьшится, и сам характер движения будет все более напоминать движение молекул газа.
Почему же поверхность спокойной жидкости представляется нам неподвижной, почему мы не замечаем непрерывного дрожания молекул?
Еще Ломоносов в одном из своих сочинений писал: «Ведь нельзя отрицать существование движения там, где его не видно: кто, в самом деле, будет отрицать, что когда через лес проносится сильный ветер, то листья и сучки дерев колышутся, хотя бы при рассматривании издали глаз не видел движения. Точно так же, как здесь вследствие расстояния, так и в теплых телах вследствие малости частиц движущейся материи, колебание ускользает от взора».
И в самом деле. Посмотрите на лезвие безопасной бритвы. Каким ровным и гладким оно нам представляется. А теперь взгляните на рисунок 21.
На нем изображен маленький участок того же лезвия, каким он виден в электронный микроскоп. А ведь обычные по своим размерам молекулы и в электронный микроскоп не видны. Неудивительно, что тепловое движение молекул нельзя увидеть.
 Рис. 21. Так выглядит маленький участок лезвия безопасной бритвы под электронным микроскопом.
Рис. 21. Так выглядит маленький участок лезвия безопасной бритвы под электронным микроскопом.
Какую же скорость имеют молекулы жидкости?
Оказывается, что средняя скорость теплового движения молекул жидкости такая же, как и у газа, молекулы которого имеют тот же вес, взятого при той же температуре. И так же, как и у газов, у жидкостей скорость беспорядочного движения молекул растет с ростом температуры.
Таким образом, тепловое движение молекул жидкости, особенно при высокой температуре, имеет черты сходства с движением молекул газа, не исключающие, однако, существенного различия. Это различие еще более усугубится, если учесть, что полная беспорядочность в расположении молекул, характеризующая газ, сменяется у жидкостей некоторой упорядоченностью. Если мысленно выделить, отметить каким-либо способом одну из молекул жидкости, то окажется, что ближайшая к ней молекула будет всегда находиться на совершенно определенном расстоянии от нее и это расстояние одинаково для всех окружающих ее молекул.
Это уже элемент порядка!
Примечательно, что упорядоченность в расположении частиц жидкости ограничивается только ближайшим окружением выбранной молекулы. Положение молекул, следующих за ближайшими соседями отмеченной молекулы, уже не будет так точно определенно, как положение ее непосредственных соседей.
Здесь возможны некоторые отступления: в одном опыте вторая молекула встретится ближе, в другом дальше, чем ей надлежало бы быть. Еще менее определенно положение третьей молекулы. По мере удаления от исходной молекулы порядок в расположении частиц быстро исчезает. Про жидкость говорят, что в ней существует
ближний порядок в расположении молекул.
Может возникнуть вопрос: каким образом упорядоченное расположение частиц вблизи любой произвольно выбранной молекулы сочетается с хаотичным расположением вдали от нее? Ведь казалось бы, что, переходя от выбранной молекулы к соседней, а от той к следующей и продолжая подобный переход все дальше и дальше, можно пройти через всю жидкость. И если всякий раз вблизи молекулы будет наблюдаться упорядоченное расположение ее соседей, то как будто бы эта упорядоченность должна охватывать всю жидкость. Но в действительности это не так. Понять это помогает рисунок 22, на котором показано, как можно представить себе расположение молекул в жидкости.
 Рис. 22. В жидкости сохраняется только ближний порядок в расположении молекул.
Рис. 22. В жидкости сохраняется только ближний порядок в расположении молекул.
Всякий раз, когда мы измеряем расстояние между двумя соседними молекулами, оно оказывается одним и тем же. Однако если соединить две соседние молекулы прямой линией и продолжить ее в обе стороны, то станет ясно, что, двигаясь вдоль намеченного направления, мы будем встречать следующие за ближайшими соседями молекулы, в зависимости от случая, на самых различных расстояниях от исходной.
И все же, взглянув на рисунок, никто не скажет, что в изображенном расположении молекул-шариков порядок вообще отсутствует. Конечно, приведенный рисунок не является точным изображением истинного расположения молекул жидкости, а представляет собой только схему, поясняющую мысль.
Понять свойства жидкости можно лишь в том случае, если постоянно держать в уме еще одну важную особенность их молекулярного строения.
Неощутимое давление
Благодаря тому, что молекулы жидкости расположены очень близко друг к другу, каждая из них с большой силой притягивается окружающими. Если молекулы газа можно уподобить рою мошек, в котором любая движется независимо от своих соседей, то молекулы жидкости следовало бы сравнить с пчелиным роем, севшим на ветку. В севшем рое каждая пчелка крепко держится ножками за ближайшую соседку, та, в свою очередь, за свою соседку, и так весь рой оказывается связанным, несмотря на то, что форма его непрерывно изменяется. Подобным же образом связаны между собой все молекулы жидкости.
Силы молекулярного притяжения так быстро убывают при увеличении расстояния между молекулами, что, по существу, любая из них связана только со своими ближайшими соседями. Вокруг молекулы существует некоторая область, внутри которой проявляется молекулярное притяжение (рис. 23), и можно без особенно большой ошибки предположить, что молекулы, лежащие за границей этой области, уже не испытывают притяжения со стороны молекулы, расположенной в ее центре.
 Рис. 23. Сфера молекулярного действия.
Рис. 23. Сфера молекулярного действия.
Очевидно, что молекулы, находящиеся в толще жидкости, притягиваются соседними с одинаковой силой во всех направлениях. Благодаря этому силы притяжения взаимно уравновешиваются и никак не сказываются на поведении молекул.
Иначе будет обстоять дело у молекул, лежащих вблизи поверхности. Для них область, в которой сказывается взаимное притяжение, будет частично заполнена жидкостью, а частично — паром (рис. 24).
 Рис. 24. Молекулы в поверхностном слое жидкости.
Рис. 24. Молекулы в поверхностном слое жидкости.
В каком-либо объеме жидкости молекул в тысячи раз больше, чем в таком же объеме пара, и поэтому силы молекулярного притяжения не могут в этом случае быть уравновешены. Сила, действующая со стороны той части, которая заполнена жидкостью, гораздо больше противоположной ей, направленной в сторону пара. В результате прилегающий к поверхности слой будет с большой силой притягиваться молекулами, лежащими в глубине жидкости. Это равносильно добавочному давлению, как бы оказываемому поверхностным слоем на жидкость. Можно даже подсчитать, какое нужно было бы приложить давление, чтобы удержать молекулы жидкости в занимаемом ими объеме, если бы внезапно они перестали притягивать друг друга. Результат этих расчетов многим покажется удивительным. Молекулярное притяжение частиц воды равносильно добавочному давлению в 17 000 атмосфер. Для сравнения укажем, что такое давление оказывает столб воды высотою 170 километров.
Давление, вызванное притяжением частиц, называют
молекулярным давлением.
Невольно возникает вопрос: почему такие большие давления как будто никак не проявляются? Почему мы можем опустить руку в воду, не опасаясь, что она будет мгновенно раздавлена? Понять это помогает рисунок 25.
 Рис. 25. Молекулярное давление всегда направлено в глубину жидкости и уравновешивается взаимным отталкиванием частиц.
Рис. 25. Молекулярное давление всегда направлено в глубину жидкости и уравновешивается взаимным отталкиванием частиц.
Молекулярное давление всегда направлено от поверхности жидкости в ее глубину и уравновешивается взаимным отталкиванием частиц. Поэтому, какой бы предмет ни погрузить в жидкость, молекулярное давление не будет на нем сказываться. Чтобы почувствовать присутствие молекулярного давления, надо изменить расстояние между молекулами, например уменьшить объем жидкости — сжать ее.
Теперь ясно и то, почему так трудно сжать жидкость, — она и в обычном состоянии уже очень сильно сжата взаимным притяжением частиц.
Можно продемонстрировать притяжение молекул еще более убедительно. Жидкость оказывает большое сопротивление попыткам ее разорвать. В этом сопротивлении разрыву жидкости наглядно проявляются силы сцепления молекул.
Особенно просто это можно показать с помощью прибора, изображенного на рисунке 26.
 Рис. 26. Прибор для определения сопротивления жидкости разрыву.
Рис. 26. Прибор для определения сопротивления жидкости разрыву.
Основной частью его является особая упругая трубка, называемая сильфоном. Сильфон заполняется жидкостью и закрывается имеющимся внизу игольчатым затвором. Верхний конец прибора закрепляется. Постепенно увеличивая вес гирь на чашке, подвешенной к нижней части прибора, жидкость растягивают до тех пор, пока она не разорвется. Разрыв жидкости легко заметить по характерному щелчку, которым он сопровождается.
Как оказалось, столбик воды, имеющий в поперечнике 5 сантиметров, может выдержать нагрузку в 5 тонн, то-есть на таком столбике можно подвесить нагруженный мощный автомобиль «ГАЗ-51» (рис. 27).
 Рис. 27. Столбик воды, имеющий в поперечнике 5 сантиметров, выдерживает нагрузку в 5 тонн.
Рис. 27. Столбик воды, имеющий в поперечнике 5 сантиметров, выдерживает нагрузку в 5 тонн.
Хотя цифры, получаемые при подобных опытах, и очень велики, они все же меньше истинной прочности жидкостей. Причиной тому мельчайшие пузырьки воздуха, всегда присутствующие в жидкостях. Эти пузырьки так же уменьшают прочность жидкости, как трещинки или пустоты в металлических деталях.
Взаимное притяжение частиц жидкости вызывает не только появление молекулярного давления, — им объясняются многие другие свойства жидкости и в первую очередь особенности жидкой поверхности.
Невидимая пленка
Молекулы жидкости, лежащие вблизи ее поверхности, притягиваются не только теми, которые расположены ниже их, но и своими соседями справа и слева. Поэтому поверхность жидкости оказывается как бы покрытой тончайшей натянутой пленкой. В существовании этой пленки легко убедиться. Налейте в чайный стакан воды до самого края, а затем осторожно прилейте еще немного. При некоторой сноровке можно добиться, чтобы жидкость выступала над краями стакана (рис. 28).
 Рис. 28. Поверхностная пленка не дает воде перелиться через край стакана.
Рис. 28. Поверхностная пленка не дает воде перелиться через край стакана.
Что же удерживает жидкость и не дает ей перелиться через края? Ее удерживает поверхностная пленка, образованная притягивающимися друг к другу молекулами.
Можно проделать и такой опыт: возьмите небольшую стеклянную трубочку, засосите в нее воды и, закрыв верхний конец трубочки пальцем, приподнимите ее. Убрав палец, дайте возможность образоваться капле и вновь закройте трубочку. Почему образовавшаяся капля не отрывается? (Рис. 29).
 Рис. 29. Висящую каплю удерживает поверхностная пленка.
Рис. 29. Висящую каплю удерживает поверхностная пленка.
Можно подумать, что капле мешает оторваться атмосферное давление. Но это неверно. Если увеличить размеры капли, она оторвется. Капля удерживается той же поверхностной пленкой, которая не давала воде переливаться через край стакана.
Этот опыт позволяет измерить ту силу, которая действует в поверхностном слое жидкости. Капля оторвется тогда, когда ее вес сравняется с силой, удерживающей ее. Вес капли легко определить: накапав в стакан 10 или 20 капель и взвесив его, найдем вес жидкости, а разделив полученную величину на число капель, вычислим и вес отдельной капли.
Найденная сила распределяется равномерно вдоль линии, по которой капля присоединяется к трубочке, то-есть вдоль окружности последней. Поэтому, если мы хотим охарактеризовать силу, действующую в поверхностном слое жидкости, надо еще полученную величину разделить на длину окружности поперечного сечения трубочки. Так удается определить то, что называют
коэффициентом поверхностного натяжения, а часто просто
поверхностным натяжением жидкости.
Коэффициент поверхностного натяжения жидкостей — небольшая величина. Она измеряется числом дин на один сантиметр.
Дина — единица силы, приблизительно равная весу комара, а точнее — одной девятьсот восьмидесятой части грамма.
Поверхностная пленка жидкости стремится сократиться. Согните проволочку в виде буквы П и укрепите на ее ножках подвижную перекладинку (рис. 30).
 Рис. 30. Мыльные пленки.
Рис. 30. Мыльные пленки.
Затем приготовьте мыльный раствор, такой же, какой употребляется для выдувания мыльных пузырей, опустите в него сделанный приборчик, а затем выньте его. Мыльная пленка сейчас же подтянет подвижную перекладинку к вершине буквы П. Взяв осторожно перекладинку за края, можно оттянуть ее вниз, но стоит только отпустить перекладинку, как она сейчас же подтянется к вершине. Подтягивает перекладинку стремящаяся сократиться поверхностная пленка. Если опустить в мыльный раствор прополочный каркасик, а затем вынуть его, то на нем возникнет тонкая пленочка. Придавая каркасику различную форму, можно получить очень причудливые пленки.
Форма возникшей пленки всегда удовлетворяет одному правилу: из всех возможных в данных условиях пленок возникает та, у которой самая малая поверхность.
Вы, наверно, замечали, что маленькие капельки имеют форму шариков, и это неспроста. Шару присуще замечательное свойство: при заданном объеме, или, что то же самое, при заданном количестве вещества, шар является телом с наименьшей поверхностью.
Таким образом, форма капелек вызвана опять-таки стремлением поверхности жидкости сделаться возможно меньше. Этим же объясняется подъем или опускание жидкости в тоненьких трубочках, называемых капиллярами.
Когда трубочку погружают в жидкость, в местах соприкосновения жидкости со стенками трубочки частицы твердого тела приходят во взаимодействие с частицами жидкости. Если взаимодействие молекул жидкости с частицами твердого тела больше, чем взаимодействие молекул жидкости между собой, то говорят, что жидкость смачивает твердое тело, если же меньше — не смачивает.
В узкой трубочке поверхность смачивающей жидкости будет вогнутой (рис. 31), несмачивающей — выпуклой (рис. 32).
 Рис. 31. Смачивающая жидкость в капилляре.
Рис. 31. Смачивающая жидкость в капилляре.
 Рис. 32. Несмачивающая жидкость в капилляре.
Рис. 32. Несмачивающая жидкость в капилляре.
И вогнутая и выпуклая поверхности стремятся сократиться. Сокращаясь, вогнутая поверхность подтягивает жидкость кверху и делается плоской. Однако в силу взаимодействия частиц жидкости и твердого тела поверхность жидкости не может быть плоской, — она снова сделается вогнутой. Вогнутая поверхность вновь сократится и вновь подтянет за собой жидкость. Жидкость начнет подниматься вверх по трубочке.
Когда же этот подъем остановится?
Ответить на этот вопрос несложно, ведь подтянутый в трубочке столбик жидкости висит, поддерживаемый натяжением поверхностной пленки. Совершенно ясно, что подъем прекратится тогда, когда сила, стремящаяся сократить пленку, уравновесится весом поднятого столбика жидкости. Так как вес столбика будет меньше в тонких трубочках, то в них жидкость будет подниматься выше, чем в толстых. В стеклянной трубочке диаметром в один миллиметр вода поднимается всего на 3 сантиметра; диаметром в одну десятую миллиметра — на 30 сантиметров, а в очень тонкой трубочке, диаметр которой составляет одну тысячную часть миллиметра, вода поднимется уже на 30 метров. Этим можно воспользоваться для определения диаметра тонких стеклянных трубочек. В самом деле, достаточно опустить трубочку в воду и измерить, насколько в ней вода будет возвышаться над уровнем воды в широком сосуде, для того чтобы определить диаметр трубочки, не производя никаких других измерений.
Взгляните на рисунок 33.
 Рис. 33. График для определения диаметра капилляра.
Рис. 33. График для определения диаметра капилляра.
На нем вдоль горизонтальной линии отложена высота подъема воды. Отметив наблюдаемый подъем, надо провести вертикально вверх линию до пересечения с изображенной на рисунке кривой. Из точки пересечения этих линий проводят горизонтальную линию до пересечения с линейкой, по которой и узнают диаметр трубочки.
Сокращение выпуклой поверхности будет вызывать понижение уровня жидкости в узкой трубочке по сравнению с уровнем жидкости в широком сосуде.
В узкой трубочке уровень несмачивающей жидкости будет располагаться ниже, чем в широком сосуде.
Подъем жидкости в тонких трубочках, или, как его называют, капиллярный подъем, играет большую роль в природе. Особенно велико значение капиллярного подъема в водном режиме почвы. Когда идет дождь, почва увлажняется; однако значительная часть влаги сразу же уходит вглубь, до уровня грунтовых вод. Выше этого уровня важную роль в удержании влаги играет капиллярное поднятие воды. Вода удерживается в порах, образованных отдельными частицами почвы, теми же силами, которые удерживают воду в узких трубочках. Чем тоньше поры, тем выше поднимется вода в почве. В песках высота подъема воды невелика — всего несколько десятков сантиметров. Наибольший подъем наблюдается в суглинистых и глинистых почвах, где он достигает 2–3 метров.
Все эти явления имеют большое значение для сельского хозяйства, — их обязательно надо учитывать при орошаемом земледелии. При неправильном орошении грунтовые воды могут подняться до высоты, соответствующей высоте капиллярного подъема воды. В этом случае восходящий ток воды в порах достигнет поверхности почвы, и если вода содержит растворенные соли, то она вынесет их на поверхность. В жаркое и сухое время, когда вода быстро испаряется, в почве может накопиться большое количество солей: почва засолится.
Силы поверхностного натяжения очень малы, и можно подумать, что в технике и промышленности, где дело имеют с большими силами, о поверхностном натяжении не следует и вспоминать.
Практика показала, что это не так.
Начало нашего века ознаменовалось постройкой первых пловучих городов — гигантских океанских пароходов. Когда эти корабли были спущены на воду, инженеры столкнулись с неожиданным затруднением: по неизвестной причине гребные винты кораблей приходили в полную негодность, проработав всего несколько часов. Сходные разрушения наблюдались у лопаток мощных гидротурбин.
Несколько лет понадобилось ученым, чтобы найти причину загадочных разрушений. Внимательно изучив работу винта, они установили, что в разрушении металла повинны мельчайшие пузырьки, возникающие в воде при вращении винта. Поверхностная пленка этих пузырьков стремится сократиться, так что пузырьки существуют недолго, — возникнув, они быстро захлопываются и исчезают. Натяжение поверхностной пленки пузырька создает внутри него добавочное давление. Когда пузырек велик, давление мало, но по мере уменьшения пузырька оно возрастает. Что это действительно так, легко доказать: возьмите две стеклянные трубочки, выдуйте на одном из концов каждой из них по мыльному пузырю и соедините вместе свободные их концы резиновой трубочкой (рис. 34).
 Рис. 34. Давление пленки меньшего пузырька заставляет его сокращаться, перегоняя воздух в больший пузырь.
Рис. 34. Давление пленки меньшего пузырька заставляет его сокращаться, перегоняя воздух в больший пузырь.
Спустя несколько мгновений вы заметите, как меньший из мыльных пузырей начнет сокращаться, перегоняя воздух, заключенный в нем, в большой пузырь. Иногда даже больший пузырь не выдерживает этого и лопается. Это убеждает нас в том, что действительно, чем меньше пузырьки, тем больше в них давление.
Как показывает расчет, при захлопывании микроскопических пузырьков, образующихся в воде, в них возникают огромные давления в тысячи атмосфер.
Под действием такого большого давления стенки пузырьков сокращаются с большой скоростью, и захлопывание пузырьков действует подобно микроскопическим ударам, разрушающим поверхность металла.
При вращении гребного винта или лопастей гидротурбины в жидкости возникает целое облако пузырьков. Поверхность металла оказывается под непрерывным градом ударов жидкости. Сильные и частые удары жидкости являются, несомненно, одной из причин того, что даже прочные материалы быстро разрушаются (рис. 35).
 Рис. 35. Разрушение гребного винта, вызванное захлопыванием образующихся в жидкости пузырьков.
Рис. 35. Разрушение гребного винта, вызванное захлопыванием образующихся в жидкости пузырьков.
Чудесные вещества
При желании поверхностное натяжение жидкости можно изменить. Этого удается достигнуть, добавляя к ней специальные вещества. Особенно легко понизить поверхностное натяжение, — для этого бывает достаточно добавить к жидкости ничтожное количество примеси. Так, например, совсем небольшая добавка мыла резко уменьшает поверхностное натяжение воды.
Для того чтобы убедиться в этом, возьмите чайное блюдечко, налейте в него чистой воды и бросьте на ее поверхность небольшие кусочки бумаги (рис. 36).
 Рис. 36. Разбегание бумажек по поверхности воды.
Рис. 36. Разбегание бумажек по поверхности воды.
Постарайтесь распределить бумажки равномерно по всей поверхности, а затем осторожно прикоснитесь к жидкости в центре блюдечка кусочком мыла, заточенным наподобие карандаша. Как только мыло коснется воды, бумажки разбегутся в разные стороны. Почему это происходит?
В месте прикосновения мыла к воде возникает мыльный раствор, поверхностное натяжение которого много меньше поверхностного натяжения чистой воды. Чистая вода как бы растягивает образовавшееся пятнышко раствора на всю поверхность жидкости, увлекая при этом плавающие на поверхности бумажки.
У растворов солей и сахара поверхностное натяжение больше, чем у чистой воды. Поэтому если повторить опыт с бумажками, прикасаясь к чистой воде кусочком сахара, то бумажки будут не разбегаться, а, наоборот, собираться к тому месту, где сахар касается воды. Для успеха этих опытов необходимо лишь, чтобы каждый раз вода на блюдечке была совершенно чистой, свободной от примесей.
Способностью уменьшать поверхностное натяжение воды обладают вещества, выделяемые жировыми железками, расположенными в кожном покрове человека. Это дает возможность показать, как разбегаются бумажки от обычной швейной иголки, если провести ею предварительно по коже, лучше всего около носа, где расположено много желез.
Поверхностное натяжение морской воды вблизи расположенных на берегу поселений в несколько раз меньше, чем в открытом море. Причина этого — загрязнение морской воды органическими веществами, попадающими в море вместе со сточными водами.
Замечательно, что вещество, понижающее поверхностное натяжение воды, часто бывает само почти нерастворимо в ней, в этом случае оно содержится практически только в поверхностном слое.
Очень интересное явление можно наблюдать, если на блюдечко с чистой водой насыпать маленькие крупинки камфоры. Отдельные крупинки при этом начинают оживленно двигаться. Вот крупинка устремилась внезапно вперед, она налетает на стенку блюдечка, отскакивает, сталкивается с другой, вдруг начинает быстро вращаться, потом снова устремляется вперед… Движение крупинок так похоже на движение живых существ, что само явление назвали «пляской камфоры». Объясняется это опять же тем, что поверхностное натяжение раствора камфоры меньше, чем у чистой воды, а растворение крупинок происходит неравномерно. В какое-то мгновение вырвавшийся поток молекул камфоры снижает поверхностное натяжение воды и одновременно отталкивает крупинку, так же как при выстреле приклад ружья отталкивает плечо стреляющего. В результате этого сложного взаимодействия и возникают причудливые движения камфоры — крупинки начинают плясать.
Частицы мыла располагаются в поверхностном слое не беспорядочно.
Химики знают, что молекула мыла напоминает длинную цепочку, утолщенную на одном из концов. Свойства разных частей подобной нитеобразной молекулы различны. Утолщенный конец притягивается водой, в то время как остальная цепочка водою выталкивается. Благодаря этому мыльный слой на поверхности напоминает частокол или густую щетку (рис. 37).
 Рис. 37. Строение поверхностного слои водного раствора мыла.
Рис. 37. Строение поверхностного слои водного раствора мыла.
У мыльного пузыря две поверхности — внутренняя и внешняя, обе они покрыты частоколом молекул (рис. 38).
 Рис. 38. Поверхностные слои в мыльном пузыре.
Рис. 38. Поверхностные слои в мыльном пузыре.
Торчащие из воды нитеобразные концы молекул мыла лишь слабо взаимодействуют друг с другом. Поэтому поверхности мыльных пузырей могут соприкасаться, а пузыри сливаться не будут. Обладая некоторой сноровкой, удается иногда выдуть один мыльный пузырь в другом (рис. 39) так, что меньший будет лежать в большем.
 Рис. 39. Два мыльных пузыря, один в другом.
Рис. 39. Два мыльных пузыря, один в другом.
Крупинки камфоры пляшут только на чистой поверхности воды. Прикоснитесь к поверхности кусочком мыла — крупинки замрут и будут неподвижно лежать на водной поверхности.
Для прекращения «пляски камфоры» достаточно слоя мыла в одну молекулу. Ученые воспользовались этим и подсчитали, при каком количестве мыла крупинки камфоры перестают двигаться по поверхности воды. Узнав, сколько необходимо для этого мыла, уже не трудно было определить число молекул, покрывающих поверхность воды, а затем и площадь, приходящуюся на отдельную молекулу, или, другими словами, ее размеры. Как оказалось, поперечник молекулы составляет несколько стомиллионных долей сантиметра.
Свойства веществ, повышающих поверхностное натяжение, и тех, которые его понижают, взаимно противоположны. Это приводит к тому, что, добавив к раствору мыла поваренной соли, повышающей поверхностное натяжение воды, мы заставляем часть растворенного мыла выделиться из раствора. Подобное выделение вещества называется «высаливанием», им пользуются при производстве мыла.
Вещества, изменяющие поверхностное натяжение, находят очень широкое применение в самых различных областях науки и техники.
Достаточно упомянуть, что на применении веществ, изменяющих поверхностное натяжение, основан один из наиболее распространенных способов обогащения руд, называемый флотацией. Широко используются подобные вещества при приготовлении многочисленных эмульсий, находящих себе самое разнообразное применение в различных областях техники, медицине, быту…
Жидкость превращается в пар
В жизни мы постоянно наблюдаем превращение вещества из жидкого состояния в газообразное. Присмотримся повнимательнее к этому явлению.
Вот, например, блюдечко с водой. Каждый знает, что спустя некоторое время вода испарится. Каким же образом это происходит?
Молекулы жидкости непрерывно движутся. Движутся и те молекулы, которые находятся вблизи поверхности. Казалось бы, что если молекула движется по направлению к границе, отделяющей жидкость от воздуха, то она обязательно покинет жидкость и перейдет в воздух: образуется водяной пар. Однако дело не так просто.
Когда молекула приблизится к поверхности, силы притяжения частиц, расположенных ниже, будут стремиться ее удержать. Она сможет преодолеть притяжение и покинуть жидкость только в том случае, если будет двигаться очень быстро. Быстро движущихся молекул в жидкости немного, и поэтому жидкости испаряются не очень быстро. Чем выше температура жидкости, тем больше в ней быстрых молекул и тем скорее жидкость превращается в пар. Мы знаем, что мокрое белье высыхает на солнышке быстрее, чем в тени. На теплой печке вода, налитая на блюдце, испаряется скорее, чем на холодном подоконнике.
Но ведь если отрываются от поверхности только быстро движущиеся молекулы, то при испарении их количество в жидкости должно непрерывно уменьшаться. В свою очередь, если число быстрых молекул будет делаться меньше, то, очевидно, будет уменьшаться и средняя скорость движения частиц, а следовательно, и температура жидкости. Налейте на ладонь руки какую-либо легко летучую жидкость — эфир, спирт, бензин — и, поднеся руку ко рту, подуйте на ладонь. Вы тотчас же почувствуете охлаждение, оно вызывается испарением жидкости. Кто не дрожал от холода на легком ветерке даже в сравнительно теплый день, вылезая после купанья из реки?! И здесь охлаждение обусловлено быстрым испарением воды. Достаточно вытереться насухо, и ощущение холода исчезнет.
Поместив блюдечко с водой под колокол воздушного насоса и быстро откачивая воздух вместе с образующимся паром, можно настолько ускорить испарение, что вода на блюдечке замерзнет.
Таким образом, для того чтобы жидкость испарялась без понижения температуры, к ней необходимо непрерывно подводить тепло. Подводимая теплота не вызывает повышения температуры и потому называется
скрытой теплотой испарения.
Различные жидкости имеют и различную скрытую теплоту испарения; для испарения одного грамма спирта требуется иное количество тепла, чем для испарения такого же количества керосина или эфира.
Особенно велика скрытая теплота испарения воды. Количеством теплоты, необходимым для того, чтобы превратить в пар один грамм воды, можно было бы нагреть пять с половиной граммов воды от нуля градусов до кипения.
Конечно, скрытая теплота испарения не исчезает бесследно. Она выделяется вновь при превращении пара в жидкость. Этим широко пользуются в технике при устройстве различных нагревателей.
На рисунке 40,
а изображен нагреватель, в котором обогревающий пар поступает в змеевик, конденсируется в нем, а выделяющаяся скрытая теплота парообразования нагревает окружающую змеевик жидкость.
Конструкции нагревателей очень разнообразны. Так, например, холодную жидкость можно поместить в сосуд, окруженный «паровой рубашкой» (рис. 40,
б).
 Рис. 40. Паровые нагреватели: а — змеевик, б — «паровая рубашка».
Рис. 40. Паровые нагреватели: а — змеевик, б — «паровая рубашка».
Омывая холодные стенки сосуда, пар здесь также превращается в жидкость, выделяя необходимое для нагревания тепло. В одних случаях более целесообразна одна конструкция нагревателя, в других — другая. Ценным качеством парового обогрева является автоматическая регулировка наибольшей температуры, достижимой в нагревателе. Совершенно ясно, что конденсирующимся водяным паром нельзя нагреть жидкость больше, чем до температуры кипения воды, так как в этом случае образовавшаяся вода вновь будет превращаться в пар, забирая на это тепло, выделяемое при конденсации.
Охлаждение жидкости при испарении используется при устройстве холодильных машин.
Испарение воды играет огромную роль в жизни природы.
Мы уже говорили, как много испаряется воды с поверхности земли. Из общего количества испарившейся влаги почти девять десятых приходится на моря и океаны. На этот процесс тратится гигантское количество солнечной энергии, которая как бы запасается «впрок» в земной атмосфере.
Понятно, что в жарких странах вблизи экватора испаряется гораздо больше влаги, чем в странах с умеренным или холодным климатом. Испарение с морской поверхности смягчает климат приморских стран. Смягчающее влияние моря приводит к тому, что разница между средними летними и зимними температурами вблизи моря меньше, чем вдали от него. Действительно, в Сочи, например, эта разница составляет 17,5 градуса, а в Москве около 30 градусов. Испарившиеся вблизи экватора массы воды вместе с воздушными потоками распространяются над поверхностью земли. Попав в более холодные области, пары начинают конденсироваться, отдавая воздуху тепло, захваченное на экваторе.
Так в природе в гигантских масштабах осуществляется выравнивание температуры, которое в наше время еще не под силу человеку.
Подвижное равновесие
Одним из подвигов легендарного римского героя Геркулеса была битва с лернейской гидрой. Трудно было победить сказочное чудовище. Девять голов имела гидра, и на месте каждой отрубленной головы вырастали тотчас же две новые.
Стремление человека познать окружающий мир, вырвать у природы ее тайны до некоторой степени напоминает этот поединок Геркулеса. Найденный ответ на какой-либо вопрос, расширяя наши знания о природе, тотчас же вызывает к жизни новые вопросы, так же настоятельно требующие объяснения, как и первый.
Яркий пример этого непосредственно перед глазами: движение молекул позволило понять, почему жидкость испаряется, но сейчас же возник вопрос, почему в бутылке, наполовину наполненной водой и плотно закрытой пробкой, вода не превращается целиком в пар, даже если бутылку поставить в теплое место.
Означает ли это, что молекулы жидкости потеряли способность отрываться от поверхности и переходить в пар? Нет, конечно. Быстро движущиеся частицы жидкости по-прежнему покидают ее, но только теперь этот процесс компенсируется встречным — переходом молекул пара в жидкость, или, как говорят, конденсацией пара.
Постараемся лучше понять происходящее явление.
Как мы знаем, молекулы жидкости сравнительно редко отрываются от ее поверхности. Это удается примерно только одной из тысячи частиц, пытающихся покинуть жидкость. Девятьсот девяносто девять остальных возвратятся обратно, — их остановит притяжение соседей.
Молекулы пара, двигаясь беспорядочно, так же как и молекулы жидкости, ударяются о ее поверхность. Внешне оба явления весьма сходны, но достаточно внимательно присмотреться к ним, чтобы заметить существенное различие.
Предположим, что одна из частиц пара приближается к поверхности жидкости. Молекул пара, стремящихся удержать ее, немного. Когда частица достигнет поверхности, притяжение молекул жидкости будет гораздо больше, чем притяжение молекул пара. Если только поверхность жидкости ничем не загрязнена, то практически каждый удар частицы пара о поверхность сопровождается переходом ее в жидкость. Когда жидкость только что налита в какой-либо сосуд и последний плотно закрыт, то первоначально в парообразном состоянии молекул немного и покидает жидкость больше частиц, чем приходит за то же самое время из части сосуда, наполненной паром, — жидкость испаряется.
По мере испарения число молекул в парообразном состоянии увеличивается, а одновременно растет и число ударов их о поверхность жидкости: скорость конденсации возрастает.
Скорость же испарения, если температура жидкости не изменяется, остается постоянной, и совершенно ясно, что рано или поздно скорость конденсации, возрастая, сделается равной скорости испарения. В каждое мгновение жидкость будет терять столько же частиц, сколько поступает в нее из пара. Испарение как бы прекратится.
Теперь становится понятным и то, почему плотность жидкости всегда значительно больше плотности ее пара.
Для того чтобы число испаряющихся молекул сделалось равным числу конденсирующихся, необходимо, чтобы в каждое мгновение о поверхность, разделяющую жидкость и пар, ударялось гораздо больше частиц жидкого вещества, чем парообразного. А так может обстоять дело только в том случае, если плотность пара много меньше плотности жидкости. Равновесие наступает тогда, когда между плотностями пара и жидкости устанавливается определенное соотношение. Это соотношение изменяется при изменении температуры; при каждой температуре для каждой жидкости оно имеет определенную величину. Иными словами, испарение жидкости в закрытом сосуде продолжается до тех пор, пока не установится определенное давление пара, при котором скорости испарения и конденсации выравниваются.
Обычно испарение происходит только с поверхности жидкости, но при некоторых условиях пузырьки пара образуются и внутри нее. Это наблюдается при такой температуре, когда давление пара жидкости делается равным атмосферному давлению. Температуру, при которой происходит образование пузырьков пара внутри жидкости, называют
температурой кипения, а само явление —
кипением.
Каждое вещество имеет свою собственную температуру кипения. Температура кипения воды при нормальном давлении принята за 100 градусов. Эфир кипит при 34,6 градуса, спирт — при 78,3 градуса, ртуть — при 357 градусах.
Когда жидкость кипит, температура ее остается постоянной до тех пор, пока вся она не испарится.
На практике часто наблюдается задержка в возникновении кипения, когда необходимая температура уже достигнута, а жидкость не кипит. Такая жидкость называется перегретой. Перегретая жидкость неустойчива: спустя некоторое время она бурно вскипает, — жидкость толчком подбрасывается вверх.
Особенно часто перегревается жидкость при длительном кипячении, когда из нее удаляется растворенный в ней воздух, мельчайшие пузырьки которого облегчают закипание, делают кипение спокойным.
Химики, которым часто приходится длительно кипятить жидкости, научились предупреждать перегрев. Оказывается, достаточно бросить в колбу с нагреваемой жидкостью кусочки фарфора, маленькие металлические пирамидки или обрезки стеклянных трубочек, чтобы кипение происходило спокойно.
Нетрудно догадаться, в чем причина этого. Между острыми краями кусочков фарфора или металлических пирамидок оказываются зажатыми очень тонкие слои жидкости, легко перегревающиеся и создающие пузырьки пара, необходимые для равномерного кипения. Таким способом, создавая искусственно местные небольшие области перегретой жидкости, удается избежать перегрева всей массы вещества. Важную роль в предупреждении перегрева играют также газы, заключенные в порах кусочков фарфора: они облегчают возникновение пузырьков пара нагреваемой жидкости.
Температура кипения зависит от внешнего давления. Понижение давления вызывает понижение температуры кипения. В местностях, расположенных высоко над уровнем моря, атмосферное давление ниже нормального; поэтому там вода кипит уже не при 100 градусах, а при более низкой температуре.
Город Ереван расположен на высоте 950-1 200 метров над уровнем моря, — в Ереване вода кипит приблизительно при температуре 96–97 градусов.
Увеличение внешнего давления вызывает повышение температуры кипения. В паровом котле, в котором давление 10 атмосфер, вода кипит при температуре приблизительно 180 градусов.
Так как жидкость не может существовать при температуре выше критической, а последняя для воды 374 градуса, то нельзя построить паровой котел, который работал бы при температуре еще более высокой. Температуре 374 градуса соответствует давление пара приблизительно 218 атмосфер. Это наивысшее давление, достижимое в паровых котлах, работающих на воде.
Вязкость
Сказочные успехи достигнуты наукой за последние сто лет. Развитие электротехники, поставившее на службу человеку энергию рек и водопадов, завоевание воздуха, изобретение радио, овладение неисчерпаемыми запасами ядерной энергии и многие другие достижения техники, — их все невозможно даже перечислить, — никогда бы не стали реальностью, если бы не опирались на бурное развитие всех отраслей знания. Поэтому неудивительно, если иногда у человека возникает мысль о том, что какое-либо явление природы он изучил полностью и ничего нового в нем уже открыть нельзя.
Эта мысль ошибочна!
Природа бесконечна, и познание ее никогда не остановится. Не составляет исключения и атомное учение. И в этой очень старой области знания имеется еще много неизвестного. За примерами не надо ходить далеко. Достаточно указать, что до сих пор мы не можем удовлетворительно объяснить одно из важнейших свойств жидкости, называемое вязкостью.
В обыденной жизни слово «вязкость» употребляется очень часто. Мы говорим, например, что мед более вязок, чем подсолнечное масло, а подсолнечное масло, в свою очередь, более вязко, нежели вода.
Но как определить точно, что такое вязкость, как ее измерить?
Попытаемся присмотреться повнимательнее к поведению какой-либо сильно вязкой жидкости и сравнить ее свойства со свойствами жидкости мало вязкой.
Представьте себе, что вы размешиваете ложкой густую сметану. Рука непосредственно чувствует усилие, которое необходимо для того, чтобы ложка двигалась. Размешайте той же ложкой чай. Для этого потребуется гораздо меньшее усилие. Очевидно, движение твердого тела в мало вязкой жидкости встречает меньшее
сопротивление, чем в жидкости сильно вязкой. Вот вам и один из способов измерить вязкость жидкости: достаточно определить сопротивление, испытываемое при движении в ней твердым телом правильной формы, например небольшим шариком.
Наряду с этим способом вязкость часто измеряется иначе. Сравните, как вытекают из одинаковых бутылок такие жидкости, как вода и густой мед. У многих при выливании меда из бутылки невольно возникает желание потрясти ее, для того чтобы мед вытекал скорее. Чем больше вязкость жидкости, тем медленнее она течет. Сравнив время протекания по узенькой трубочке одного и того же количества двух различных жидкостей, мы узнаем, во сколько раз вязкость одной жидкости больше или меньше вязкости другой.
Приняв условно, что вязкость чистой воды при 20 градусах равна 0,01, мы найдем таким способом, что вязкость касторового масла равна 12, то-есть в тысячу двести раз больше, а вязкость эфира — 0,0026, то-есть в четыре раза меньше, чем вязкость воды.
Когда для определения вязкости жидкости измеряется сопротивление, оказываемое ею движению твердого тела, надо помнить, что сопротивление будет возрастать не только при увеличении вязкости, но и при увеличении размеров тела. Кроме того, вязкость жидкости — только одна из причин сопротивления движению тела. Она играет главную роль, когда движение происходит с небольшой скоростью. Движущееся тело как бы раздвигает слои жидкости, которые спокойно соединяются сзади него (рис. 41).
 Рис. 41. Слоистое течение жидкости.
Рис. 41. Слоистое течение жидкости.
С возрастанием скорости картина движения изменяется. Частицы жидкости приобретают вращательное движение, течение делается пульсирующим, в жидкости возникают вихри (рис. 42), приводящие к перемешиванию жидкости.
 Рис. 42. Вихри в жидкости.
Рис. 42. Вихри в жидкости.
Возникновение вихрей требует дополнительного усилия при движении тела в жидкости. Сопротивление движению делается больше. Чем энергичнее вихреобразование, тем больше сопротивление.
Для образования вихрей большое значение имеет форма тела. Здесь может оказаться более выгодным воспользоваться телом больших размеров, но обладающим формой, ослабляющей образование вихрей. Такая форма называется
обтекаемой.
Вязкость газов и, в частности, воздуха ничтожно мала. Вызванным ею сопротивлением можно свободно пренебречь. Иначе обстоит дело с сопротивлением, вызванным образованием вихрей при быстром движении. В этом случае сопротивление может быть очень большим. Именно поэтому предметам, предназначенным для движения с большой скоростью в воздухе или в жидкости, придают обтекаемую форму.
В чем же причина вязкости, как она связана с молекулярным строением вещества?
Природу вязкости газов удалось объяснить давно. Предположим, что в газе движутся в направлении слева направо две соприкасающиеся струйки: одна быстрее, вторая медленнее (рис. 43).
 Рис. 43. Возникновение внутреннего трения в газе.
Рис. 43. Возникновение внутреннего трения в газе.
Беспорядочное тепловое движение молекул газа заставляет частицы, движущиеся в одной из струек, залетать в другую. Этот залет частиц компенсируется встречным. В результате молекулы, попавшие из струи, движущейся быстрее, в более медленную, будут ускорять ее движение, а встречные им, попав в быстро движущийся поток газа, будут его тормозить.
Как мы видим, вязкость, или внутреннее трение, газа вызвана переносом разного количества движения. Молекулы, уходящие из быстро движущегося потока, уносят количество движения большее, чем приносят поступающие на их место.
Это объяснение позволило предвидеть некоторые особенности поведения газов. Так, например, удалось подсчитать изменение вязкости газов при изменении температуры. Результат оказался неожиданным: если газ нагревать в закрытом сосуде, то согласно расчету вязкость его возрастает. Многим это казалось невозможным, однако опыт подтвердил предвидение теории: газ, который нагревается без увеличения объема, делается более вязким.
Правильный расчет вязкости газов много способствовал утверждению в науке атомного учения.
Значительно хуже обстоит дело с объяснением вязкости жидкостей. Воспользоваться теми же рассуждениями, которые дали возможность объяснить вязкость газов, нельзя, потому что они приводят к противоречащей опыту зависимости вязкости жидкости от температуры.
Это не означает, что в движущейся жидкости перенос разного количества движения не играет никакой роли. Несомненно, это явление имеет место в жидкости и влияет на ее свойства. Однако при объяснении вязкости необходимо учитывать особенности молекулярного строения жидкости, отличающие ее от газа. Вероятно, решающее значение здесь имеет энергичное молекулярное взаимодействие, отсутствующее в газах.
Как бы там ни было, можно с полным основанием утверждать, что, несмотря на большое количество предложенных теорий, до сих пор не существует исчерпывающего объяснения вязкости жидкости.
Вязкость жидкости быстро возрастает при понижении температуры. Наоборот, при нагревании вязкость жидкости уменьшается.
При перевозке некоторых жидкостей в зимние месяцы их вязкость настолько увеличивается, что для выгрузки загустевшую массу приходится подогревать.
Иногда при понижении температуры вязкость возрастает настолько, что жидкость теряет одно из своих основных свойств — подвижность частиц, она перестает течь.
Это наблюдается, например, у каменноугольного дегтя, или, как его иногда называют, вара. Каменноугольный деготь — составная часть асфальта, которым покрывают улицы городов, автомобильные дороги.
Нагретый вар — подвижная жидкость. При охлаждении его подвижность уменьшается, каменноугольный деготь начинает напоминать густую сметану.
При еще более низкой температуре это уже не вязкая жидкость, а блестящее твердое тело с характерным острым изломом. Однако в затвердевшем варе взаимная подвижность частиц не полностью потеряна. Положите на кусок вара небольшой камень или металлическую гирьку и оставьте в покое. Через несколько дней на поверхности вара образуется отпечаток лежавшего на нем предмета.
К такого же рода веществам, как и каменноугольный деготь, относятся различные смолы, стекла, эмали…
Более подробно с их свойствами мы познакомимся позже.
Жидкость превращается в твердое тело
В жизни можно часто наблюдать превращение жидкости при охлаждении ее в твердое тело.
Иногда это происходит, как мы только что рассказали, вследствие увеличения вязкости, и тогда наблюдается плавное превращение жидкости в твердое тело. Жидкость все более теряет текучесть, пока не уподобится по своим механическим свойствам твердому телу.
Чаще, однако, жидкость превращается в твердое тело скачкообразно, при определенной для каждого вещества температуре. Это явление называют
кристаллизацией, а температуру, при которой оно происходит,
температурой кристаллизации.
При кристаллизации изменяется строение тела и одновременно скачкообразно изменяются его свойства.
Но хотя каждое вещество имеет совершенно определенную температуру кристаллизации, на практике жидкость легко охладить ниже этой температуры, и все же она останется жидкостью. Такую жидкость называют
переохлажденной.
Переохлажденная жидкость неустойчива. Достаточно внести в нее маленький кристаллик или даже просто энергично встряхнуть сосуд, в котором она находится, и жидкость быстро закристаллизуется. Особенно легко переохлаждается расплавленный гипосульфит — основная часть фиксажа, употребляемого для «закрепления» фотографических пластинок. Гипосульфит легко расплавить в стеклянной колбе. Образовавшуюся жидкость надо профильтровать и оставить спокойно стоять, Как правило, температура опускается до комнатной, а гипосульфит остается жидким, — он переохлажден.
Если в колбу с переохлажденным гипосульфитом бросить кристаллик, то он начнет быстро расти и большая часть содержимого колбы затвердеет.
Почему же не затвердеет весь гипосульфит?
Чтобы понять это, приложите к колбе ладонь. Вы сразу почувствуете, что колба горячая.
Оказывается, жидкость, охлажденная до температуры кристаллизации, не превращается в твердое тело, даже если бросить в нее для затравки маленькие кристаллики. Для того чтобы жидкость превратилась в твердое тело, от нее надо отвести выделяющееся при кристаллизации тепло. Именно выделение теплоты при затвердевании переохлажденного гипосульфита и нагрело колбу. Конечно, переохлажденная жидкость может нагреться только до температуры кристаллизации. При более высокой температуре образующееся твердое тело будет вновь плавиться.
Замечательно, что, несмотря на отвод тепла от затвердевающей жидкости, ее температура остается постоянной все время, пока продолжается кристаллизация.
Плавление твердого тела требует затраты такого же количества тепла, какое выделяется при затвердевании. Естественно, теплоту, поглощаемую при плавлении твердого тела и выделяющуюся при затвердевании жидкости, назвали
скрытой теплотой плавления, или
скрытой теплотой кристаллизации.
Скрытая теплота кристаллизации разных жидкостей различна. Особенно велика скрытая теплота кристаллизации воды. Теплоты, которая выделяется при превращении одного грамма воды в лед, достаточно для того, чтобы нагреть это количество воды от нуля приблизительно до 80 градусов, то-есть она равна 80 калориям.
То, что при превращении воды в лед выделяется очень много тепла, имеет большое значение в жизни природы. С наступлением морозов замерзание рек и озер происходит не мгновенно, а постепенно. Превращаясь в лед, вода выделяет в окружающее пространство скрытую теплоту кристаллизации. Это замедляет кристаллизацию воды, замерзание происходит более медленно, постепенно.
Когда наступает весна и начинается таяние льда и снега, большая скрытая теплота плавления льда спасает нас от ужасного половодья, наступившего бы, будь она меньше, например как у свинца, у которого она составляет приблизительно одну тринадцатую часть скрытой теплоты плавления льда, то-есть всего 6 калорий.
Если вспомнить, что ледниковый покров на Земле занимает примерно одну девятую часть суши, и если прибавить к нему область вечной мерзлоты — одну пятую часть суши, то станет ясным, какую большую роль в жизни природы играет таяние льда и замерзание воды.
При этом подсчете мы не учитывали земную поверхность, занесенную снегом в зимнее время. Прибавив же ее, мы получили бы еще более поразительные цифры. Ежегодно в течение нескольких месяцев площадь, покрытая льдом и снегом, превышает половину всей суши. Обладай вода меньшей теплотой плавления, климат на Земле был бы иным, пришлось бы привыкнуть к гораздо более резким изменениям температуры, чем те, с которыми мы имеем дело сейчас.
Переохлаждение жидкостей приходится учитывать в технике. Вода особенно легко переохлаждается в том случае, если она находится в форме мельчайших капелек — тумана. Переохлажденный туман — большая опасность для авиации. Ударяясь о поверхность летящего самолета, переохлажденные капельки мгновенно замерзают, — самолет начинает обледеневать. Если температура очень низкая, а, как показывает опыт, капельки могут быть жидкими и при 25-градусном морозе, и если размеры капелек малы, то они замерзают целиком и представляют для самолета меньшую опасность, чем большие капли. Последние при ударе о самолет распластываются и образуют прочный слой льда, который крепко держится на поверхности самолета. При обледенении вес самолета возрастает, форма крыльев изменяется, может нарушиться управление, обледенение винта снижает мощность мотора.
Оледенение самолета особенно опасно потому, что оно может происходить очень быстро. Многократно наблюдалось, что слой льда толщиной в пять сантиметров вырастал на крыле самолета всего за одну минуту!
Кристаллизация жидкости облегчается, если в ней присутствуют так называемые центры кристаллизации. Ими могут служить мельчайшие, микроскопические кристаллики, примеси измельченных нерастворимых в жидкости веществ, невидимые невооруженным глазом различные пылинки. Легче идет кристаллизация на поверхности твердого тела, например на стенках сосуда, содержащего жидкость. Если в переохлажденную воду погрузить стеклянную трубочку с тонким открытым снизу концом и положить внутрь нее кусочек льда, то первоначально превратится в лед вода внутри трубочки, а когда вся она затвердеет, на конце трубочки вырастет красивый кристалл льда, имеющий форму шестилучевой звездочки. Если не профильтровать расплавленный гипосульфит, в нем останутся центры кристаллизации и переохладить его не удастся.
В природе мы постоянно сталкиваемся с превращениями парообразного вещества в жидкое и жидкого в твердое. Летним вечером от реки колеблющейся пеленой тянется туман. Это пары воды превратились в мельчайшие водяные капельки.
Ясным осенним утром невольно залюбуешься красивым узором инея, который разукрасил крыши домов, чугунную ограду сада, телеграфные провода…
Это та же вода, превратившаяся в твердое состояние.
Что же происходит с мельчайшими частицами вещества — молекулами, когда жидкое тело превращается в твердое, как изменяется их движение, как они располагаются в твердом теле?
III
В МИРЕ ПОРЯДКА
Кристаллы
При затвердевании объем почти всех жидкостей уменьшается. Поэтому можно считать, что, как правило, молекулы или атомы в твердых телах расположены еще ближе друг к другу, чем в жидкостях.
Если в газе молекулы находятся в хаотичном беспорядке, а в жидкости беспорядочное движение молекул сочетается с некоторым порядком в их расположении, то в твердых телах частицы располагаются уже в полном порядке.
Ученые нашли способы узнавать, как расположены частицы, образующие твердые тела. Оказывается, в твердых телах частицы занимают строго определенные положения. При затвердевании жидкости соседние частицы вещества располагаются в вершинах правильных геометрических тел: кубов, пирамид, призм и т. д.
Все хорошо знают обычную поваренную соль, употребляемую в пищу. Каждая крупинка такой соли представляет собою один или несколько соединенных вместе кубиков.
Такая форма частиц соли не случайна.
Поваренная соль — это химическое соединение двух различных веществ: хлора и натрия.
Частицы, образующие кристалл поваренной соли, являются не молекулами хлора и натрия, а электрически заряженными атомами этих веществ, так называемыми ионами. Ионы в каждой крупинке поваренной соли расположены так, как это изображено на рисунке 44 (крупные шарики — ионы хлора, более мелкие — ионы натрия).
 Рис. 44. Расположение ионов в кристалле поваренной соли.
Рис. 44. Расположение ионов в кристалле поваренной соли.
Такое расположение ионов наиболее компактно, не занятое ими пространство сведено к минимуму. В науке такое расположение называют плотной упаковкой.
Для того чтобы закономерность в строении твердого тела показать более наглядно, удобно расположение шариков-ионов, при котором какой-либо ион загораживает соседние с ним, заменить расположением их центров, как это сделано на рисунке 45.
 Рис. 45. Кристаллическая решетка поваренной соли.
Рис. 45. Кристаллическая решетка поваренной соли.
В этом случае черные шарики — центры ионов натрия, а белые — центры ионов хлора. Каждый черный шарик окружен шестью белыми, а каждый белый, в свою очередь, — шестью черными.
Такой порядок наблюдается в любой части крупинки поваренной соли.
Порядок в расположении частиц, из которых построены твердые тела, объясняет их правильную форму.
Если перед вами лежит бесформенная глыба, то это не означает еще, что в ней нарушен присущий твердому телу порядок частиц. Отколите маленькую крупинку и посмотрите на нее в лупу или микроскоп. Вы увидите четкие грани и ребра правильных геометрических фигур. Глыба образовалась в результате случайного сращения множества маленьких частиц правильной формы.
Так, поваренная соль, где бы мы ее ни получили — в соляных копях, из солончаковых озер близ Каспийского моря или из вод Северного Ледовитого океана, — всегда имеет форму кубиков.
Если разбить кубик поваренной соли, он рассыплется на несколько меньших кубиков.
Твердые тела, имеющие присущую им от природы правильную форму, вызванную правильным расположением частиц, их образующих, называют
кристаллами.
Остов кристалла, который получается, когда изображают расположение центров образующих кристалл частиц, называют кристаллической решеткой, а те места, в которых эти центры помещаются, — узлами кристаллической решетки.
Не у всех кристаллических тел частицы расположены так же, как у поваренной соли.
Замечательный русский кристаллограф Е. С. Федоров математическим путем доказал возможность существования 230 разновидностей симметрических фигур, в которые могут слагаться атомы в кристаллах.
Существует твердое тело — графит.
Графит построен из частичек углерода, из которого состоит и обычный древесный уголь. Проведите куском графита по твердой поверхности — останется черный след. Такая мягкость графита, способность его «мазаться», обеспечивает возможность применения его в качестве материала для изготовления карандашей и особых смазок.
Дело в том, что графит, не плавясь, выносит температуру более 2 тысяч градусов, поэтому графитные смазки можно применять тогда, когда нельзя воспользоваться никакими другими. Из графита изготовляют огнеупорные тигли, в которых плавят самые тугоплавкие вещества.
Кристаллическая решетка графита изображена на рисунке 46. Как мы видим, она состоит из отдельных слоев, каждый из которых напоминает рисунком паркетный пол.
 Рис. 46. Кристаллическая решетка графита.
Рис. 46. Кристаллическая решетка графита.
Обратите внимание на то, что соседние атомы углерода, лежащие в одном и том же слое, почти в два с половиной раза ближе друг к другу, чем соседние же, но расположенные в смежных слоях. Эта особенность определяет многие свойства графита.
Чем ближе друг к другу частицы вещества, тем больше действующие между ними силы. Поэтому атомы углерода, образующие какой-либо слой, связаны между собою гораздо прочнее, чем атомы, принадлежащие соседним слоям. Малое сцепление соседних слоев позволяет им легко скользить один по другому, а это дает возможность использовать графит для приготовления смазки. Этим же объясняется тот факт, что графит чаще всего встречается в виде чешуек.
Строение кристалла в первую очередь зависит от химического состава вещества, и поэтому можно, казалось бы, думать, что каждому веществу свойственна только одна определенная кристаллическая решетка. Но это не так. У многих веществ частицы могут располагаться, образуя кристаллические решетки различных типов. Все знают, как красиво сияют в лучах света отшлифованные алмазы, или, как их называют, бриллианты. А ведь алмаз состоит из тех же самых атомов углерода, что и черный, матовый графит, только кристаллическая решетка алмаза совсем не похожа на решетку графита (рис. 47).
 Рис. 47. Кристаллическая решетка алмаза.
Рис. 47. Кристаллическая решетка алмаза.
Иное расположение атомов приводит к совершенно иным свойствам. Графит — мягкое тело, алмаз — самый твердый минерал, из него не приготовишь смазки. Графит не прозрачен, алмаз прозрачен. Графит — хороший проводник электрического тока, алмаз тока не проводит. Эти различия в свойствах вызваны разным расположением атомов, разным строением решетки.
Вообще говоря, при определенных условиях одна форма кристаллической решетки может превратиться в другую. Эта мысль была движущей пружиной бесчисленных попыток искусственного получения алмазов. До сих пор эти попытки оставались безуспешными. Вероятно, образование алмазов в природе происходило при условиях, которые не удается воспроизвести. Оно протекало в результате кристаллизации углерода, растворенного в расплавленных магмах при очень высоком давлении и быстром охлаждении. Искусственное же получение алмазов пытались осуществить при таких условиях, когда более устойчивой формой кристаллического углерода являлся графит.
В 1940 году советский ученый О. П. Лейпунский определил границы температур (2000°) и давлений (60 тысяч атмосфер), при которых в природе происходил процесс кристаллизации алмазов.
У некоторых веществ превращение одной кристаллической формы в другую происходит довольно легко. Подобное превращение однажды явилось причиной большого несчастья.
В 1910 году известный полярный исследователь Р. Скотт отправился на корабле «Терра нова» в экспедицию к Южному полюсу. Полюса экспедиция достигла в январе 1912 года. На обратном пути Р. Скотт и его четыре спутника погибли. Как оказалось, причиной их гибели была потеря жидкого топлива: бачки, в которых оно находилось, разрушились. Это произошло в результате превращения олова, которым были пропаяны бачки, из привычного для нас белого олова в порошкообразное серое.
Белое и серое олово различаются так же, как и алмаз и графит, строением кристалла. При температурах ниже 18 градусов более устойчиво серое олово, однако скорость превращения обычного олова в порошкообразное серое при температуре, не слишком сильно отличающейся от 18 градусов, ничтожно мала. При понижении же температуры скорость образования серого олова возрастает, достигая максимальной величины при — 33 градусах. Это и привело к гибели отважных путешественников.
Превращение белого олова в серое значительно ускоряется, если добавить к нему затравку — крупинку серого олова. Затравка может быть очень малой, — иногда достаточно привести обычное олово в соприкосновение с серым, чтобы превращение пошло быстро; серое олово как бы «заражает» своим прикосновением белое.
В средние века домашняя утварь делалась из различных сплавов, основной частью которых было олово. И если в каком-нибудь доме на тарелке, ложке или ином предмете образовывалось небольшое количество серого олова, такой предмет «заражал» другие и вся утварь разрушалась. Это бедствие очень напоминало эпидемическое заболевание, и народ, со свойственной ему меткостью, назвал его «оловянной чумой». Особенно страдали от «оловянной чумы» органные трубы, изготовлявшиеся из чистого олова.
Красивы и разнообразны кристаллы различных веществ (рис. 48).
 Рис. 48. Внешний вид различных кристаллов.
Рис. 48. Внешний вид различных кристаллов.
Многие из них вы можете получить сами. Прибавьте к горячей воде какое-либо вещество, например поваренную соль или квасцы, в таком количестве, чтобы оно перестало в ней растворяться. Перемешайте раствор, дайте нерастворившемуся веществу осесть на дно и осторожно слейте прозрачный раствор в чистый стакан. Поставьте стакан с раствором в теплое, защищенное от тряски место. Через несколько дней, когда часть жидкости испарится, на дне стакана выпадут кристаллы растворенного вещества.
Когда переохлаждение невелико и кристаллизация происходит медленно, образуются большие, с правильными гранями кристаллы. Если же жидкость сильно переохладить и тем ускорить рост кристаллов, то они приобретают причудливый вид переплетенных нитей или ветвистого дерева.
Вспомните тонкие морозные узоры на окнах: здесь можно увидеть и цветы, и деревья, и замысловатые орнаменты, превосходящие сложностью то, что может создать фантазия художника.
Особенно красивы и разнообразны формы снежинок (рис. 49).
 Рис. 49. Снежинки.
Рис. 49. Снежинки.
Они возникают потому, что снежинка, падая на землю, непрерывно перемещается из одного слоя атмосферы в другой и при этом непрерывно изменяются условия кристаллизации — иными делаются температура, количество водяных паров и т. д.
Не все кристаллы состоят из атомов или ионов. Существуют кристаллы, состоящие из молекул.
Примером тому сухой лед, которым охлаждают мороженое. Это превращенный в твердое кристаллическое тело углекислый газ. Частицы, образующие кристалл сухого льда, — молекулы. Они, так же как и ионы в кристалле поваренной соли, уложены с возможно большей плотностью. Однако молекулы углекислого газа имеют более сложную форму, чем шарики-ионы, и уложить их плотно труднее. Поэтому упаковка кристалла, состоящего из молекул (рис. 50), получается более рыхлой, чем у кристалла, состоящего из ионов или атомов.
 Рис. 50. Строение кристалла сухого льда.
Рис. 50. Строение кристалла сухого льда.
Особенно неплотно упакованы молекулы воды в кристалле льда, модель которого изображена на рисунке 51. Для удобства здесь атомы водорода (черные шарики) и кислорода (белые шарики) изображены одинаковыми, хотя в действительности их размеры различны.
 Рис. 51. Строение кристалла обычного льда.
Рис. 51. Строение кристалла обычного льда.
Ажурный характер кристалла льда — причина его малой плотности: мы знаем, что лед плавает на поверхности воды.
При таянии льда молекулы укладываются более плотно и объем, занимаемый веществом, уменьшается.
Свойства кристаллов
Упорядоченное расположение частиц делает свойства кристаллов не похожими на свойства жидкостей и газов.
Жидкость, например, одинаково сопротивляется растяжению, вне зависимости от того, в каком направлении ее растягивать. Если жидкость разрывается, то никаких определенных плоскостей, по которым преимущественно происходил бы этот разрыв, указать нельзя. Один раз разрыв произойдет так, другой раз иначе.
Совсем по-иному ведут себя кристаллы.
В каждом из них имеются плоскости, по которым разрыв происходит легче, чем по другим. Они называются плоскостями спайности.
Кристалл поваренной соли, какова бы ни была его форма, раскалывается на кусочки, каждый из которых кубик или прямоугольный параллелепипед.
Слюда от самого незначительного усилия расщепляется на отдельные пластинки. При желании можно изготовить тончайшие слюдяные пластинки, более тонкие, чем бумажный листок.
Эти особенности кристаллов объясняются строением их кристаллических решеток.
Взгляните на кристаллическую решетку поваренной соли. На плоскостях, параллельных какой-либо грани куба, располагаются вперемежку ионы натрия и ионы хлора. Ионы натрия, находящиеся в одной плоскости, будут притягиваться ионами хлора, лежащими в соседней плоскости, и одновременно отталкиваться лежащими в этой плоскости одноименными с ними ионами натрия. А так как ионов натрия и ионов хлора в каждой плоскости одинаковое количество, то такие плоскости будут притягиваться одна к другой в общем с небольшой силой. Это и есть плоскости спайности.
Иная картина наблюдается на диагональных плоскостях (рис. 52).
 Рис. 52. Диагональные плоскости в кристалле поваренной соли.
Рис. 52. Диагональные плоскости в кристалле поваренной соли.
Здесь на одной плоскости встречаются только ионы натрия, а на соседних с нею только ионы хлора. Силы сцепления между такими плоскостями велики, и кристалл по диагональным плоскостям не раскалывается.
В слюде, так же как и в графите, частицы, лежащие в одном и том же слое, связаны между собою гораздо крепче, чем расположенные в соседних слоях. Поэтому слюда и расщепляется на тонкие листочки.
В том, что свойства кристаллов различны в различных направлениях, можно убедиться, проделав такой простой опыт.
В природе часто встречаются прозрачные кристаллы горного хрусталя, обычно они образуют красивые сростки — друзы (рис. 53).
 Рис. 53. Друзы горного хрусталя.
Рис. 53. Друзы горного хрусталя.
Горный хрусталь, или кварц, — это соединение кремния с кислородом, или, как говорят химики, двуокись кремния. Кварц — распространенный минерал. На его долю приходится примерно 12 процентов вещества земной коры.
Покроем одну из боковых граней кристалла кварца ровным слоем воска и прикоснемся к ее середине концом раскаленной проволоки. Распространяющееся от проволочки тепло заставит воск расплавиться, образуется лунка в форме эллипса (рис. 54).
 Рис. 54. Плавление воска на поверхности кристалла кварца.
Рис. 54. Плавление воска на поверхности кристалла кварца.
Почему лунка имеет такую форму?
Да потому, что тепло, идущее от конца проволочки, распространяется вдоль поверхности кристалла в разных направлениях, с разной скоростью. Способность кристалла проводить тепло, его теплопроводность, различна в разных направлениях. В том направлении, в котором теплопроводность кристалла больше, края лунки отстоят дальше от конца проволочки. В этом направлении и будет вытянут эллипс.
Еще более своеобразно поведение кристаллов по отношению к лучам света.
В 1669 году датский врач и математик Эразм Бартолин обнаружил, что предметы, рассматриваемые через прозрачную пластинку, сделанную из кристалла исландского шпата, кажутся раздвоенными (рис. 55).
 Рис. 55. Двойное лучепреломление.
Рис. 55. Двойное лучепреломление.
Происходит это потому, что в этом кристалле луч света распадается на два луча, идущих по разным направлениям. Открытое Бартолином явление назвали двойным лучепреломлением. Замечательно, что в том же кристалле исландского шпата можно найти такое направление, двигаясь вдоль которого световой луч не будет распадаться на два луча и кристалл будет подобен обычному стеклу.
Рассматривая особенности кристаллических тел, нельзя забыть об одном их удивительном свойстве, находящем в наше время важное применение в технике, а именно — о пьезоэлектрическом эффекте.
Если из кристалла кварца вырезать пластинку так, как это показано на рисунке 56, и сжать ее, то на противоположных гранях пластинки возникнут электрические заряды. Одна грань зарядится положительно, противоположная ей — отрицательно.
 Рис. 56. Пьезопластинка.
Рис. 56. Пьезопластинка.
При замене сжатия растяжением электрические заряды тоже появятся, но только знаки их будут обратными: грань, заряженная раньше положительно, теперь будет нести отрицательный заряд, и наоборот. Чем больше сжатие или растяжение пластинки, тем больше и возникающие заряды.
По-гречески слово «пьезо» означает давление, слово «эффект» — действие; поэтому появление электрических зарядов под действием давления и назвали пьезоэлектрическим эффектом.
Пьезоэлектрический эффект обратим. Это означает, что если противоположные грани пластинки зарядить разноименным электричеством, то в зависимости от того, какая грань заряжена положительно, а какая отрицательно, пластинка или сожмется или сделается более толстой.
Пьезоэлектрические кристаллы используются в многочисленных приборах, предназначенных для измерения давления. Действительно, для того чтобы узнать давление, достаточно измерить величину возникшего заряда, а это в наше время можно сделать очень точно.
То, что мы называем звуком, представляет собою чередующиеся сжатия и разряжения воздуха, воды или какого-либо другого материала, в котором звук распространяется. Естественно, что пьезоэлектрические кристаллы можно использовать и для устройства чувствительных приемников звука — пьезокристаллических микрофонов.
Пьезокристаллические микрофоны широко применяются в гидроакустике для обнаружения приближающихся судов или подводных лодок.
Обратный пьезоэлектрический эффект используется при устройстве кристаллических излучателей звука. Особенно велико значение этих приборов (рис. 57) при получении ультразвуков, находящих себе все более широкое применение в технике, биологии, медицине.
 Рис. 57. Пьезоэлектрический излучатель ультразвука.
Рис. 57. Пьезоэлектрический излучатель ультразвука.
Жидкости, которые не текут
Наше знакомство с твердыми телами будет неполным, если не упомянуть о твердых телах, не имеющих правильной формы, характерной для кристаллов.
Взгляните на кусок оконного стекла. Специальной машиной ему придана хорошо знакомая нам форма тонкой пластинки. Если разбить кусок стекла, то среди осколков не удастся обнаружить правильных кристаллов. Очевидно, частицы стекла не расположены в таком строгом порядке, как частицы, образующие кристаллы. Современная наука подтверждает это заключение.
Тела, которые по своим механическим свойствам являются твердыми телами, но частицы которых расположены недостаточно упорядоченно для того, чтобы образовать кристаллы, называют
аморфными телами.
Почему же возникают аморфные тела?
Ответ на этот вопрос мы, по существу, уже знаем: иногда при охлаждении жидкостей их вязкость настолько возрастает, что они теряют текучесть и по механическим свойствам уподобляются твердым телам.
Большая вязкость мешает частицам занять строго упорядоченное положение, характеризующее кристалл. Чем больше вязкость жидкости, тем труднее она кристаллизуется. Вязкость чистого глицерина более чем в тысячу раз превосходит вязкость воды. Кристаллизация глицерина происходит с большим трудом. Именно поэтому глицерин вплоть до второй половины XIX века был известен только как жидкость, хотя открыли его еще в XVIII веке.
Практически, для того чтобы получить кристаллический глицерин, в жидкость необходимо ввести несколько кристалликов его, которые послужат затравкой.
В 1867 году в Лондон из Вены привезли бочки с глицерином. Открывавшие бочки чиновники были озадачены: вместо ожидаемой жидкости бочки оказались наполненными неизвестными кристаллами. Как показал анализ, это были кристаллы глицерина, возникшие благодаря редкой комбинации движений при качке судна, перевозившего бочки. Движение судна, морская качка помогли молекулам улечься в порядке, характерном для кристалла.
Однако подобное стечение обстоятельств очень мало вероятно, и потому самопроизвольную кристаллизацию глицерина наблюдали с тех пор всего два-три раза.
При низких температурах кристаллическая форма тел более устойчива, чем аморфная; поэтому многие аморфные тела сами по себе очень медленно переходят в тела кристаллические. В стекле такой переход вызывает помутнение, а иногда и растрескивание, и известен многим из обыденной жизни. Он называется «расстекловыванием». Подобный же процесс наблюдается в аморфном сахаре, называемом «карамелью». Когда карамель самопроизвольно кристаллизуется, говорят, что она «засахаривается».
Аморфными телами являются получившие в последнее время большое распространение как в быту, так и в технике различные пластические массы.
Часто одно и то же тело может существовать как в виде кристалла, так и в виде аморфного тела.
Если расплавить кристалл кварца и затем охладить образовавшуюся жидкость, то при этом возникнут не кристаллы кварца, а аморфное кварцевое стекло.
Кварцевое стекло не обладает пьезоэлектрическим эффектом. Его свойства одинаковы во всех направлениях.
В расположении частиц, образующих аморфное тело, упорядоченность ограничивается, так же как и у жидкостей, лишь ближайшими соседями каждой из частиц.
Горный хрусталь, кварцевое стекло и многие другие вещества являются соединением атомов двух различных элементов. Если условиться изображать атомы одного из этих элементов черными кружками, а атомы другого — белыми, то соотношение в расположении частиц в кристаллическом и аморфном твердых телах можно упрощенно пояснить рисунком 58.
 Рис. 58: а — строение кристалла, б — строение аморфного стекла.
Рис. 58: а — строение кристалла, б — строение аморфного стекла.
Слева на рисунке представлено расположение атомов в кристаллах, а справа — в стекле. Мы видим, что порядок, наблюдаемый в расположении атомов в кристалле, нарушается при превращении последнего в стекло. Однако полностью порядок в стекле не исчезает. Возле каждого атома, взятого в отдельности, порядок сохраняется неизменным, но он оказывается нарушенным, если рассматривать все твердое тело целиком.
Отсутствие совершенного, характерного для кристаллов порядка приводит к тому, что у аморфных тел свойства не зависят от направления. В этом отношении аморфные тела напоминают жидкости.
Еще о движении частиц
Может показаться, что в кристаллическом теле, где господствует полный порядок, где каждая частица занимает определенное место, нельзя говорить о движении частиц. Однако это не так. И в кристаллах частицы находятся в вечном движении.
Какое же движение могут совершать частицы, занимающие неизменное положение?
Многие из вас помнят детскую загадку: «Что весь день идет, а с места не сходит?» Разгадка — «часы».
Действительно, взгляните, например, на часы-ходики. Неутомимо снует взад-вперед маятник ходиков, отсчитывая время. Вправо, влево, снова вправо и снова влево движется укрепленный на маятнике кружок.
Так же, как маятник, колеблются бесчисленные частички, образующие кристалл.
При невысоких температурах размах колебаний, совершаемых отдельными частицами, невелик. Это позволяет получать электронно-фотографические изображения крупных молекул.
Правда, и в этом случае фотография получится, вероятно, несколько «смазанной», подобно тем неудачным снимкам, которые так огорчают новичков, пытающихся фотографировать движущиеся предметы с сравнительно большой экспозицией.
Если мы подсчитаем путь, пробегаемый колеблющимися атомами за одну секунду, сложив вместе отрезки, пройденные при отдельных колебаниях, совершенных ими за это время, то заметим, что этот путь будет зависеть от температуры. Чем выше температура, тем больше путь, следовательно, тем больше частота и размах совершаемых частицами колебаний.
Таким образом, и в твердых телах, так же как и в жидкостях и в газах, для объяснения теплоты не надо прибегать к помощи таинственной «тепловой материи»; мы можем вместе с Ломоносовым сказать: «теплота состоит во внутреннем движении материи».
Итак, если у газов молекулы, в зависимости от их строения, могут двигаться или только поступательно, или же сочетая поступательное движение с вращением, то частицы твердых тел только колеблются.
Это единообразие движения частиц всех твердых тел должно сказаться на их теплоемкости.
Опираясь на учение об атомах, можно предположить, что если взять различные твердые тела в таких количествах, чтобы все они содержали одинаковое число атомов, то их теплоемкости будут одинаковыми. Как показывает опыт, при не слишком низких температурах это предположение полностью оправдывается. При одинаковом числе атомов в твердых телах их теплоемкости одинаковы.
Частицы твердых тел способны и перемещаться с места на место, но число таких «кочующих» частиц невелико. Однажды был проделан такой опыт: на тоненький золотой листочек был поставлен цилиндрик, сделанный из свинца, и оставлен в таком положении в покое. Спустя четыре года свинцовый цилиндрик был распилен сверху вниз, и оказалось, что частички золота, правда в ничтожных количествах, встречались по всей толще свинцового цилиндра. Этот опыт наглядно доказал, что какая-то доля частичек золота способна не только колебаться, но и перемещаться с места на место.
При повышении температуры количество «кочующих» частиц в твердом теле возрастает.
Каждой «кочующей» частице соответствует пустующий узел в кристаллической решетке. Чем больше частиц ведет «кочевой» образ жизни, тем больше в кристаллической решетке узлов, не занятых частицами.
С повышением температуры, с одной стороны, увеличивается частота и размах колебаний частиц, образующих кристаллическую решетку, а с другой — растет количество пустующих узлов. Это приводит к тому, что при какой-то определенной достаточно высокой температуре порядок частиц, свойственный кристаллу, нарушается, кристаллическая решетка перестает существовать, твердое тело плавится, превращаясь в жидкость.
Это происходит с каждым веществом при совершенно определенной, отличной от других веществ температуре. Именно поэтому химики часто, желая узнать, с каким веществом они имеют дело, измеряют его температуру плавления.
При любой температуре среди бесчисленного числа частиц, образующих кристаллическое твердое тело, имеются частицы как с малой, так и с большой кинетической энергией.
Если кинетическая энергия частицы достаточно велика, то частица может оторваться от поверхности твердого тела и перейти в окружающий ее газ.
Переход твердого вещества непосредственно в газ, минуя жидкость, называется
сублимацией.
Особенно легко сублимируются нафталин, иод. Этим объясняется пахучесть этих веществ.
Сублимируется и твердая углекислота. Отнимая тепло от окружающих предметов, она сама нагревается и сразу превращается в бесцветный газ, не образуя ни одной капли жидкости. Поэтому-то твердую углекислоту и называют сухим льдом.
Замечательный ребус
Какие же силы удерживают частицы твердого тела в определенных положениях, характерных для кристалла? Что мешает им разлететься по всем направлениям? Силы
молекулярного или атомного притяжения, скажете вы. Но какова природа этих сил? Что заставляет два атома или две молекулы притягивать друг друга?
Если кристалл состоит из ионов, как, например, кристалл поваренной соли, объяснить притяжение частиц друг к другу легко.
Все знают, что если потереть расческу о шерстяную материю, то она будет притягивать кусочки папиросной бумаги, соломинки и другие легкие предметы. Мы говорим, что расческа наэлектризовалась и противоположные электрические заряды притягивают друг друга.
Кристалл поваренной соли состоит из чередующихся ионов натрия и хлора. Ион натрия заряжен положительно, ион хлора — отрицательно. Благодаря электрическим зарядам ионы притягиваются один к другому, обеспечивая тем самым прочную кристаллическую решетку.
Труднее объяснить возникновение сил притяжения между совершенно одинаковыми атомами углерода в алмазе или между молекулами нафталина в кристаллическом нафталине.
Однако и в этом случае причина молекулярного притяжения коренится в электрических зарядах, имеющихся в каждом атоме или молекуле. Силы притяжения, действующие между любыми частицами, имеют, в конечном счете, электрическую природу. Величина их зависит от расстояния между частицами. На больших расстояниях эти силы невелики, но при сближении частиц возрастают: чем ближе друг к другу расположены частицы, тем сильнее они притягиваются.
Вы можете спросить, почему же тогда атомы или молекулы в кристалле остаются на определенных расстояниях, не сливаясь в одну большую атомную каплю.
Причина этого в том, что когда частицы подойдут достаточно близко одна к другой, между ними возникают силы отталкивания. Правда, молекулярное отталкивание проявляется только на очень близких расстояниях, но зато оно возрастает по мере сближения частиц гораздо быстрее, чем притяжение. В результате при определенном расстоянии между частицами силы притяжения уравновешиваются силами отталкивания. И это происходит как раз тогда, когда частицы располагаются в узлах кристаллической решетки. Поэтому в кристалле силы притяжения в точности равны силам отталкивания, и на частицы как бы не действуют никакие силы.
В 1660 году английский физик Р. Гук, исследуя поведение твердых тел под действием силы, открыл важный закон природы. По обычаю века он записал закон по-латыни и придал ему вид анаграммы:
Рассматривая этот ребус, истинные ученые могли сами из приведенных букв составить найденный Гуком закон.
При этом они получили бы:
что в переводе означает:
«Каково растяжение, такова сила».
Закон Гука сохранил свое значение до нашего времени. И теперь мы говорим: под действием силы в теле возникает растяжение; чем больше растяжение, тем больше возникшее в теле напряжение.
Атомное учение объясняет, почему это происходит. Когда на кристаллическое тело действует сила, частицы, образующие тело, смещаются из положений равновесия, — кристаллическая решетка искажается. Если при этом частицы сближаются, то верх берут силы отталкивания, возрастающие быстрее, чем силы притяжения. В теле возникает напряжение, уравновешивающее действующую силу. Чем больше сместятся частицы, тем большее возникает напряжение. Если же частицы отходят одна от другой, то преобладающими оказываются силы притяжения, уменьшающиеся с расстоянием более медленно, чем силы отталкивания.
В теле снова возникнет напряжение, уравновешивающее действующую силу, но только направлено оно будет в противоположную сторону. И опять, чем больше сместятся частицы, чем больше удлинится тело, тем больше будет возникшее напряжение.
Закон Гука позволяет правильно рассчитывать прочность различных сооружений, машин, подъемных механизмов. Пользуясь им, конструктор заранее узнает, как изменится форма создаваемой им детали под действием различных сил. Все сооружения и машины, окружающие нас, построены с учетом этого закона.
При прекращении действия силы первоначальная форма тел восстанавливается, изменение формы, или, как говорят, деформация, исчезает. Такую деформацию называют упругой. Восстановление формы вызывается внутренними напряжениями, возникающими в теле при деформации.
Однако не все деформации упруги. Увеличивая действующую силу, можно вызвать такое изменение формы, которое уже не исчезнет при удалении силы. Тело приобретет несколько иную форму — деформация сохранится. В этом случае говорят, что возникла остаточная деформация. Возникновение остаточной деформации легко объяснить с помощью атомной теории. Сохраняющееся изменение формы вызывается таким перемещением частиц, образующих кристалл, при котором плоскости спайности как бы скользят одна по другой. В результате этого скольжения частицы не только сближаются или удаляются друг от друга, но и меняются местами со своими соседями так, что какой-либо атом или ион оказывается лежащим против частицы, ранее расположенной сбоку от него. Когда действие силы, вызывающей деформацию, прекращается, характер расположения частиц в кристалле восстанавливается, внутренние напряжения исчезают, однако смещение плоскостей спайности сохраняется. Так возникает остаточная деформация.
Изучение кристаллических решеток различных твердых тел позволяет вычислить напряжения, возникающие в них при деформации.
Как мы видим, атомное учение позволяет понять и свойства твердых тел, объяснить закономерности, которым подчиняется их поведение.
Так наука решила задачу, сформулированную в свое время великим Ломоносовым: «сыскать причины видимых свойств в телах на поверхности происходящих от внутреннего их сложения».
ЗАКЛЮЧЕНИЕ
Мы рассказали о немногих из тех интересных явлений, которые связаны атомно-молекулярным строением вещества.
Теперь читателю должно быть ясно, как, учитывая движение молекул, из которых состоят все тела, можно объяснить их свойства, понять, что такое теплота, найти законы, которым подчиняются превращения вещества, и т. д.
Эти знания необходимы человеку в его практической деятельности. Без них нельзя строить совершенные двигатели, мощные самолеты, дешево получать важные для промышленности продукты. Эти знания важны нам и по другой причине. Они говорят о том, что мир материален, что движением молекул мы можем объяснить явления, протекающие в окружающей нас природе, без помощи каких бы то ни было божественных сил.
Наука не стоит на месте. С каждым годом она раскрывает все новые и новые тайны природы. Сегодня мы превосходим то, что еще вчера считали пределом наших знаний.
Не надо, однако, думать, что развитие науки представляет собой ничем не осложненное, постепенное приближение человека к истинному пониманию природы. Наука развивается в непрерывной борьбе старого, отжившего, с новым, передовым.
Широкие возможности для развития науки открыла в нашей стране Великая Октябрьская социалистическая революция.
Ученые Советской страны настойчивой работой вырывают у природы ее секреты. Не дожидаясь милостей от природы, они заставляют ее служить человеку.

Сканирование —
AbsurdMan
DjVu-кодирование —
Беспалов

Примечания
1
Перевод Ф. А. Петровского, взято из книги «Основатели кинетической теории материи», под ред. А. К. Тимирязева, ОНТИ, 1937 г.
(обратно)
Оглавление
I
ХАОС
Вместо введения
Во глубине веков
Атомы
По стопам Демокрита
М. В. Ломоносов
Молекулы
Вечное движение
Со скоростью пули
Не фантазия ли это?
Что такое теплота?
Теплоемкость
Молекулярная артиллерия
Жидкие газы
II
НА ПУТИ К ПОРЯДКУ
Колыбель жизни
Двуликий Янус
Кочующие маятнички
Неощутимое давление
Невидимая пленка
Чудесные вещества
Жидкость превращается в пар
Подвижное равновесие
Вязкость
Жидкость превращается в твердое тело
III
В МИРЕ ПОРЯДКА
Кристаллы
Свойства кристаллов
Жидкости, которые не текут
Еще о движении частиц
Замечательный ребус
ЗАКЛЮЧЕНИЕ
*** Примечания ***


 Рис. 1.
Так Демокрит объяснял, почему пахнут цветы.
Рис. 1.
Так Демокрит объяснял, почему пахнут цветы.
 Рис. 2. Так представлял себе Ломоносов столкновения и взаимодействия молекул.
Рис. 2. Так представлял себе Ломоносов столкновения и взаимодействия молекул.
 Рис. 3. Приборы, изобретенные Ломоносовым.
Рис. 3. Приборы, изобретенные Ломоносовым.
 Рис. 4. Если сложить вместе столько песчинок, сколько содержится молекул воздуха в одном кубическом сантиметре, то получится куча, которая закроет большой завод.
Рис. 4. Если сложить вместе столько песчинок, сколько содержится молекул воздуха в одном кубическом сантиметре, то получится куча, которая закроет большой завод.
 Рис. 5. Модели молекул: а — кислорода, б — углекислого газа, в — бензола.
Рис. 5. Модели молекул: а — кислорода, б — углекислого газа, в — бензола.
 Рис. 6. Молекула воды.
Рис. 6. Молекула воды.
 Рис. 7. Две молекулы, различающиеся расположением атомов.
Рис. 7. Две молекулы, различающиеся расположением атомов.
 Рис. 8. Электронный микроскоп и полученная с его помощью фотография молекул одного сложного химического соединения.
Рис. 8. Электронный микроскоп и полученная с его помощью фотография молекул одного сложного химического соединения.
 Рис. 9. Так располагаются мельчайшие частички в сосуде с водой.
Рис. 9. Так располагаются мельчайшие частички в сосуде с водой.
 Рис. 10. Схема броуновского движения.
Рис. 10. Схема броуновского движения.
 Рис. 11. При обычных температурах молекулы водорода движутся быстрее самолета и поезда.
Рис. 11. При обычных температурах молекулы водорода движутся быстрее самолета и поезда.
 Рис. 12. Устройство прибора для определения скоростей молекул.
Рис. 12. Устройство прибора для определения скоростей молекул.
 Рис. 13. Изображение щели на экране приборчика.
Рис. 13. Изображение щели на экране приборчика.
 Рис. 14. Температура различных тел. На центральном рисунке указана температура атомного взрыва.
Рис. 14. Температура различных тел. На центральном рисунке указана температура атомного взрыва.
 Рис. 15. Так измеряется кинетическая энергия тела. М — масса тела, V — его скорость.
Рис. 15. Так измеряется кинетическая энергия тела. М — масса тела, V — его скорость.
 Рис. 16. Дождь давит на открытую чашку весов с силой, которую можно измерить.
Рис. 16. Дождь давит на открытую чашку весов с силой, которую можно измерить.
 Рис. 17. Если литр воды обратить в пар, то пар при температуре кипения воды и атмосферном давлении займет цистерну объемом в 1 500 литров.
Рис. 17. Если литр воды обратить в пар, то пар при температуре кипения воды и атмосферном давлении займет цистерну объемом в 1 500 литров.
 Рис. 18. Для того чтобы сжать воду в стакане только на 4 процента, на нее нужно давить с силой в несколько десятков тонн.
Рис. 18. Для того чтобы сжать воду в стакане только на 4 процента, на нее нужно давить с силой в несколько десятков тонн.
 Рис. 19. При медленном движении палочки струя вязкой жидкости изгибается.
Рис. 19. При медленном движении палочки струя вязкой жидкости изгибается.
 Рис. 20. При быстром ударе струя разламывается, как хрупкое тело.
Рис. 20. При быстром ударе струя разламывается, как хрупкое тело.
 Рис. 21. Так выглядит маленький участок лезвия безопасной бритвы под электронным микроскопом.
Рис. 21. Так выглядит маленький участок лезвия безопасной бритвы под электронным микроскопом.
 Рис. 22. В жидкости сохраняется только ближний порядок в расположении молекул.
Рис. 22. В жидкости сохраняется только ближний порядок в расположении молекул.
 Рис. 23. Сфера молекулярного действия.
Рис. 23. Сфера молекулярного действия.
 Рис. 24. Молекулы в поверхностном слое жидкости.
Рис. 24. Молекулы в поверхностном слое жидкости.
 Рис. 25. Молекулярное давление всегда направлено в глубину жидкости и уравновешивается взаимным отталкиванием частиц.
Рис. 25. Молекулярное давление всегда направлено в глубину жидкости и уравновешивается взаимным отталкиванием частиц.
 Рис. 26. Прибор для определения сопротивления жидкости разрыву.
Рис. 26. Прибор для определения сопротивления жидкости разрыву.
 Рис. 27. Столбик воды, имеющий в поперечнике 5 сантиметров, выдерживает нагрузку в 5 тонн.
Рис. 27. Столбик воды, имеющий в поперечнике 5 сантиметров, выдерживает нагрузку в 5 тонн.
 Рис. 28. Поверхностная пленка не дает воде перелиться через край стакана.
Рис. 28. Поверхностная пленка не дает воде перелиться через край стакана.
 Рис. 29. Висящую каплю удерживает поверхностная пленка.
Рис. 29. Висящую каплю удерживает поверхностная пленка.
 Рис. 30. Мыльные пленки.
Рис. 30. Мыльные пленки.
 Рис. 31. Смачивающая жидкость в капилляре.
Рис. 31. Смачивающая жидкость в капилляре.
 Рис. 32. Несмачивающая жидкость в капилляре.
Рис. 32. Несмачивающая жидкость в капилляре.
 Рис. 33. График для определения диаметра капилляра.
Рис. 33. График для определения диаметра капилляра.
 Рис. 34. Давление пленки меньшего пузырька заставляет его сокращаться, перегоняя воздух в больший пузырь.
Рис. 34. Давление пленки меньшего пузырька заставляет его сокращаться, перегоняя воздух в больший пузырь.
 Рис. 35. Разрушение гребного винта, вызванное захлопыванием образующихся в жидкости пузырьков.
Рис. 35. Разрушение гребного винта, вызванное захлопыванием образующихся в жидкости пузырьков.
 Рис. 36. Разбегание бумажек по поверхности воды.
Рис. 36. Разбегание бумажек по поверхности воды.
 Рис. 37. Строение поверхностного слои водного раствора мыла.
Рис. 37. Строение поверхностного слои водного раствора мыла.
 Рис. 38. Поверхностные слои в мыльном пузыре.
Рис. 38. Поверхностные слои в мыльном пузыре.
 Рис. 39. Два мыльных пузыря, один в другом.
Рис. 39. Два мыльных пузыря, один в другом.
 Рис. 40. Паровые нагреватели: а — змеевик, б — «паровая рубашка».
Рис. 40. Паровые нагреватели: а — змеевик, б — «паровая рубашка».
 Рис. 41. Слоистое течение жидкости.
Рис. 41. Слоистое течение жидкости.
 Рис. 42. Вихри в жидкости.
Рис. 42. Вихри в жидкости.
 Рис. 43. Возникновение внутреннего трения в газе.
Рис. 43. Возникновение внутреннего трения в газе.
 Рис. 44. Расположение ионов в кристалле поваренной соли.
Рис. 44. Расположение ионов в кристалле поваренной соли.
 Рис. 45. Кристаллическая решетка поваренной соли.
Рис. 45. Кристаллическая решетка поваренной соли.
 Рис. 46. Кристаллическая решетка графита.
Рис. 46. Кристаллическая решетка графита.
 Рис. 47. Кристаллическая решетка алмаза.
Рис. 47. Кристаллическая решетка алмаза.
 Рис. 48. Внешний вид различных кристаллов.
Рис. 48. Внешний вид различных кристаллов.
 Рис. 49. Снежинки.
Рис. 49. Снежинки.
 Рис. 50. Строение кристалла сухого льда.
Рис. 50. Строение кристалла сухого льда.
 Рис. 51. Строение кристалла обычного льда.
Рис. 51. Строение кристалла обычного льда.
 Рис. 52. Диагональные плоскости в кристалле поваренной соли.
Рис. 52. Диагональные плоскости в кристалле поваренной соли.
 Рис. 53. Друзы горного хрусталя.
Рис. 53. Друзы горного хрусталя.
 Рис. 54. Плавление воска на поверхности кристалла кварца.
Рис. 54. Плавление воска на поверхности кристалла кварца.
 Рис. 55. Двойное лучепреломление.
Рис. 55. Двойное лучепреломление.
 Рис. 56. Пьезопластинка.
Рис. 56. Пьезопластинка.
 Рис. 57. Пьезоэлектрический излучатель ультразвука.
Рис. 57. Пьезоэлектрический излучатель ультразвука.
 Рис. 58: а — строение кристалла, б — строение аморфного стекла.
Рис. 58: а — строение кристалла, б — строение аморфного стекла.

