Стрельцов Борис Никодимович, Рукавишников Анатолий Михайлович, Коротанов Владимир Азарьевич
Хранение цветов
ПРЕДИСЛОВИЕ
Любое крупное событие нашей жизни не обходится без цветов — встречают ли гостей, празднуют ли свадьбу или день рождения, поступление в институт или его окончание, рождение ребенка или проводы в дальний путь. Цветы уместны везде: на танцевальном вечере, торжественном обеде, в экзаменационном зале и просто как украшение квартиры.
Зеленые насаждения, цветники — один из важнейших элементов благоустройства городов и сел. Кроме чисто эстетического, они имеют немаловажное санитарное значение в качестве зы от дыма, выхлопных газов, пыли. Цветники, сады, парки очищают воздух городов, сглаживают амплитуду колебаний температурно-влажностного режима, особенно в знойные дни, способствуя повышению влажности воздуха. Такие насаждения могут выполнять и водоохранные функции.
Очень важно озеленять административно-промышленные комплексы, территории детских садов, школ, других учебных заведений. Интенсивные работы по озеленению, разбивке цветников, клумб, рабаток проводят и в новых жилых кварталах.
Срезка живых цветов, а также живые цветы в горшечной культуре необходимы в течение всего года. Они используются для разных аранжировок: букетов, гирлянд, венков, корзин, декоративных композиций. Однако спрос на цветочно-декоративные растения отличается большой неравномерностью. Можно считать, что он складывается из двух компонентов. Один, относительно постоянный, образуется за счет более или менее равномерного спроса, определяемого такими потребностями, как подарки к семейным торжествам или по другим поводам. Другой возникает накануне общих праздников — Нового года, Восьмого марта, Первого мая и т. д. Именно в это время спрос на цветы резко возрастает и удовлетворить его за счет имеющихся ресурсов удается далеко не всегда, тогда как в летне-осенний период цветов вполне достаточно для удовлетворения в них потребностей населения. Так, если минимум реализации цветочной продукции Управлением лесопаркового хозяйства Мосгорисполкома, приходящийся на февраль, составляет лишь 2480 цветов, то максимум (август) достигает 7,5 млн. Для того чтобы сгладить эту неоднородность, цветы завозят из южных регионов нашей страны. Частично исправляет положение импорт цветочной продукции, но и в этом случае максимальное количество ее приходится на середину весны (апрель).

Гербера в теплице
Аналогичная ситуация складывается и в других крупных городах страны. В Ленинград ежегодно завозят около 100 т цветочной продукции, Архангельск — 27, Мурманск — 14, Свердловск— 13, Новосибирск — 8 т, в Норильск, практически лишенный собственной производственной базы, — 60 т цветов.
Выгонка цветов в теплицах и других культивационных сооружениях требует большого расхода энергии на обогрев и досвечивание с помощью источников искусственного освещения. Положение может быть существенно улучшено за счет хранения срезки и материалов для разведения цветов с применением специальной технологии, основанной на различных физических и химических методах. Регулирование метаболических процессов в срезке позволяет значительно расширить сезон реализации. Например, срезка гвоздики в условиях регулируемой газовой среды может храниться в течение 12–15 недель.
Большое значение имеет также сохранность семян и материала для вегетативного размножения и выгонки: черенков, луковиц, клубней, клубнелуковиц, корневищ.
Отход при хранении черенков гвоздики, луковиц тюльпанов, клубнелуковиц гладиолусов иногда доходит до 50–70 %. В связи с этим особую актуальность приобретает создание специализированной промышленной базы цветоводства: постройка комбинатов по выращиванию цветочно-декоративных культур, хранилищ семян и материала для вегетативного размножения, расширение сети питомников, снабжающих цветоводческие хозяйства высококачественными семенами и другим посадочным материалом.
Чтобы ликвидировать или, по крайней мере, сгладить сезонность поступления цветов в торговую сеть, нужно расширить соответствующие тепличные комбинаты в различных регионах нашей страны, обеспечить их качественным материалом для посева и выгонки цветочно-декоративных растений. Нивелировать перепады в снабжении цветами целесообразно, используя теплицы для выращивания овощей в свободное от производства основной продукции время года.
Представляет большой интерес выбор рационального цветочного ассортимента для различных климатических зон.
Выведение новых сортов и рас, приспособленных к климату, почве, другим местным условиям, связано с необходимостью сбора и хранения генетического материала цветочной пыльцы. Желательно создание новых растений, отличающихся от исходных длиной цветоноса, величиной цветка или соцветия, продолжительностью и временем цветения, ароматом. Важное значение имеет изменение времени цветения за счет различных приемов, проводимых в период хранения, к числу которых можно отнести воздействие различными температурами, химическую или электрофизическую обработку.
Для правильной организации хранения столь разнородного материала, как срезка цветов, черенки, клубни, луковицы, необходимо отчетливо представлять особенности каждой разновидности цветочной продукции. Если срезка лишена биологического механизма, обеспечивающего длительный период покоя, то в клубнях, луковицах и клубнелуковицах имеется достаточно большой запас питательных веществ, создающих предпосылки хранения в течение продолжительного времени.
Особенности физиологии цветения, синтез различных фитогормонов, регулирующих обменные реакции, процессы дыхания и транспирации, необходимо учитывать при сухом и влажном способах хранения срезки цветов. При этом имеют значение и особенности анатомического строения различных цветов, а также наличие той или иной микрофлоры. Сильное влияние на продолжительность хранения и качество продукции может оказать выделение цветами этилена.
Замедление метаболических процессов в срезке достигается различными способами, но самый простой — хранение при пониженных температурах в холодильных камерах и ледниках, причем большую роль играет специальная подготовка срезки к хранению.
Сейчас расширяется использование усовершенствованной технологии холодильного хранения, связанной с применением различных химических препаратов для обработки срезки. Хороший эффект дает холодильное хранение при пониженном давлении, что снижает интенсивность дыхания и замедляет обменные процессы. Улучшение условий хранения наблюдается и при сорбции или разложении этилена с помощью химических или электрофизических методов. Успешно применяют технологию хранения срезки роз в озонированной воде.
Газовая среда, содержащая повышенное количество углекислого газа и пониженное — кислорода, пригодна как для хранения луковиц, клубнелуковиц, клубней, так и для срезки и черенков, но особенно благоприятна для последних ввиду высокой интенсивности их дыхания. Такая среда может быть создана искусственно с помощью специальных генераторов, а также естественно за счет дыхания хранящейся продукции и диффузии газовых компонентов сквозь специальные селективные мембраны, которыми оборудуют контейнеры для хранения. Особенности физиологии семенного и разводочного материала, прежде всего сравнительно небольшая интенсивность дыхания, сказываются на выборе мембран для герметизированных контейнеров. Успешное хранение любого вида цветочной продукции в таких контейнерах возможно при условии правильного расчета, проектирования и сборки специальных устройств с учетом свойств продукции (интенсивность дыхания, дыхательный коэффициент, масса) и параметров газообменных мембран (проницаемость, селективность, площадь, загрузка).
Для создания регулируемой газовой среды применяют различные скрубберные установки, диффузионные газо-обменники, газогенераторные установки, режим работы которых выбирают на основе проведенных экспериментов. Поддерживают необходимый температурно-влажностный режим и оптимальный состав газовой смеси с помощью специального контрольно-измерительного оборудования. При использовании гибких контейнеров с газоселективными мембранами для правильного расчета мембран весьма важно определить интенсивность дыхания и дыхательный коэффициент цветочной продукции, предназначенной для хранения.
Условиями хранения посадочного материала определяется не только качество получаемых цветов, но и нередко время и сроки их цветения, устойчивость срезки цветов, находящейся в декоративном сосуде с водой или особым питательным раствором.
Таким образом, хранение высококачественного сортового посевного материала наряду с выращиванием цветов принадлежит к числу важнейших задач цветочно-декоративного садоводства. Только при рациональном решении этих задач цветоводство может быть высокорентабельной отраслью народного хозяйства, основанной на промышленной технологии и интенсивном землепользовании.
Цель настоящей книги — помочь цветоводам сократить потери как при хранении цветов, так и в период вегетации, улучшить производство и распространенных, и редких декоративных растений, расширить ассортимент цветочной продукции.
ГЛАВА 1. ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ В СРЕЗАННЫХ ЦВЕТАХ ПРИ ХРАНЕНИИ
Срезанные цветы имеют некоторые особенности, отличающие их от других видов сельскохозяйственной продукции. В противоположность семенам, плодам, клубням срезка лишена биологического механизма, обеспечивающего период покоя, что значительно затрудняет ее хранение в течение более или менее продолжительного времени. В срезанных цветах продолжаются все метаболические процессы, но изменяется их направленность. Процессы деструкции в них начинают превалировать над синтезом органических соединений (белков, жиров, углеводов). Для эффективного противодействия процессам распада необходимо создавать условия, замедляющие обменные реакции, или искусственно поддерживать условия, имитирующие нормальный обменный процесс, одновременно предотвращая распад органических веществ.
ФИЗИОЛОГИЯ ЦВЕТЕНИЯ
В соответствии с современными представлениями цветок не что иное, как побег, то есть ответвление стебля, несущее вместо листьев чашелистики, лепестки, тычинки и плодолистики. Переходные формы между листьями и прицветниками, прицветниками и частями околоцветника, чашелистиками и лепестками, лепестками и тычинками характерны для многих декоративных цветочных культур. При этом, однако, в пределах одного и того же вида растений белковый состав цветков и отдельных их элементов качественно отличается от состава вегетативных органов. В цветке происходят специфические процессы метаболизма, приводящие к синтезу компонентов лепестков, пигментов околоцветника и т. д.
Перемещение веществ, участвующих в процессах метаболизма, обеспечивается двумя путями: транспирационным потоком, то есть транспортом воды и растворенных в ней веществ от корня к побегам и листьям, и током ассимилятов, или передвижением выработанных при фотосинтезе веществ из листьев к частям растения, расположенным ниже (побеги, корень) и выше (верхушки стебля и побегов, цветки). Такая транспортировка веществ на большие расстояния идет по специальным проводящим тканям: сосудам и трахеидам ксилемы для транспирационного тока и ситовидным трубкам флоэмы для тока ассимилятов. Транспорт на короткие расстояния к проводящим тканям и от них происходит через различные элементы клеточных структур.

Традиционный метод упаковки цветов
Движение органических веществ в проводящих тканях флоэмы не сводится к простому протеканию растворов, оно связано с активным переносом молекул через протоплазму ситовидных трубок и является результатом обмена веществ. Транспирационный ток воды и растворенных в ней питательных веществ происходит в ксилеме — распределительной системе, снабжающей водой все растение. Это движение жидкости обусловлено факторами физического характера, и прежде всего различиями гидростатического давления.
Проводящая система декоративных растений может иметь вид изолированных пучков, которые на поперечном срезе цветочного побега либо расположены кольцом, либо разбросаны по всей его плоскости на относительно больших расстояниях друг от друга (например, у тюльпана), где флоэма и ксилема граничат друг с другом. Пучки могут быть различными по размерам, число составляющих их сосудов также сильно варьирует, что отражается на транспирации и токе ассимилятов.
Фитогормоны перемещаются по путям дальнего транспорта, но они могут перемещаться на большие расстояния и через неспециализированные ткани.
Инициация цветения начинается тогда, когда процесс химических и метаболических превращений в верхушечной части стебля имеет необратимый характер и образовались одна или несколько морфологических структур цветка.
Процесс инициации цветения имеет большое значение для технологии хранения, поскольку, как правило, на хранение закладывают цветы в период бутонизации или во время так называемого полуроспуска. Этот процесс можно подразделить на две основные фазы (Бернье, 1985): инициация цветочных зачатков и развитие этих зачатков во взрослые цветки. Указанные фазы не всегда четко отделяются друг от друга.
Некоторые виды декоративных кустарников характеризуются антагонизмом между бурным вегетативным ростом и цветением: факторы, приводящие к снижению интенсивности роста (засуха, обрезка, кольцевание), стимулируют цветение, и наоборот, высокий уровень минерального питания, особенно азотного, вызывает задержку цветения на фоне бурного роста растения. Помимо азота, на процесс цветения большое влияние оказывают и некоторые микроэлементы. Так, избыточное содержание ионов меди может ингибировать цветение хризантемы, в то время как наличие ионов железа инициирует цветение. Другие микроэлементы играют менее существенную роль, за исключением молибдена, недостаток которого может ускорять цветение ряда растений.

Хранение цветов в упаковках с открытой горловиной
Большое значение для инициации цветения имеет воспринимающий цвет пигмент фитохром. Многие из растений реагируют на разницу в длине светового дня, измеряемую минутами. Поэтому, регулируя длительность светового и теплового фотопериодических циклов, можно изменять сроки цветения.
Исключительно важная роль в инициации цветения принадлежит температурному режиму. При понижении температуры не наблюдается непосредственного заложения зачатков цветка, это происходит после обеспечения благоприятных для роста растений условий путем повышения температур. Однако у таких растений, как левкой, ксифиум (луковичный ирис), заложение цветков может происходить лишь под действием пониженной температуры.
Контроль и инициация цветения определяются гормоном цветения флоригеном. Этот гормон включает в себя гиббереллины и антезины, присутствующие в цветущих растениях. Стимул цветения передается от цветущего растения к нецветущему при прививке вне зависимости от того, было цветущее растение подвоем или привоем. Флориген может передвигаться как сверху вниз, так и снизу вверх. Движение флоригена в листовой пластинке происходит от клетки к клетке, вплоть до поступления во флоэму, и далее он транспортируется вместе с ассимилятами по флоэме черешка и стебля.
Гормоны необходимы растениям, они синтезируются в небольших количествах в одном из органов растения и перемещаются к другим органам благодаря ряду специфических реакций. Потребность растений в гормонах обычно невелика. Расстояние, на которое могут перемещаться гормоны, весьма различно: от листа до почки (относительно большая длина), от апикальной меристемы до лежащих ниже клеток (гораздо меньше) и от одной органеллы к другой в пределах клетки. У высших цветковых растений имеется несколько контролирующих физиологические процессы гормонов: ауксин, гиббереллины, цитокинины, абсцизовая кислота и этилен.
Ауксин контролирует скорость растяжения клеток и направление роста. Природный ауксин — индолилуксусная кислота (ИУК) образуется в верхушках стеблей. Гиббереллины — группа веществ, контролирующих цветение. Цитокинины синтезируются в корне и перемещаются вверх, взаимодействуя с ауксинами, ингибируя действие последних. Абсцизовая кислота (АБК) — гормон стресса, подавляющий активный вегетативный рост почек и инициирующий переход в состояние покоя. АБК подавляется цитокининами. Этилен — гормон созревания и старения, действие которого может быть ингибировано некоторыми веществами, в частности углекислым газом или озоном. В то же время присутствие озона в окружающей цветы атмосфере даже в малых концентрациях нежелательно, так как в течение всего нескольких часов он может вызвать полное увядание срезки цветов.
ДЫХАНИЕ ЦВЕТОВ
Сохранение высоких декоративных качеств срезанных цветов на протяжении некоторого времени — одна из наиболее трудных задач технологии хранения, поскольку физиологическое и микробиологическое разложение ткани цветов неизбежно и закономерно, а количество запасенных веществ невелико. Как всякий живой организм, срезанный цветок продолжает дышать, и в процессе дыхания происходят процессы диссимиляции — расщепления органических веществ с расходованием запасенной в них энергии, причем органический материал полностью превращается в конечные неорганические продукты — воду и углекислый газ.
Пока цветок дышит, он остается живым; с прекращением дыхания останавливается поток энергии, поддерживающий сложную структуру растительных клеток, процессы в них теряют упорядоченность, и растение погибает. Дыхательный газообмен и обусловленный им уровень окислительно-восстановительных реакций характеризуют устойчивость организма к процессам старения. Дыхание определяет общий метаболизм цветка — чем слабее и ровнее дыхание цветов, тем дольше они сохраняются, поскольку замедляются соответствующие обменные реакции.
Субстратами дыхания, помимо углеводов, могут быть жиры, белки и аминокислоты, органические кислоты (в листьях и побегах) и т. д. Обмен СО
2 и О
2 происходит на поверхности растений путем диффузии. Расщепление макромолекулярных субстратов в дыхательных процессах предшествует гидролизу: полисахариды гидролизуются до моносахаридов, жиры — до глицерина и жирных кислот, белки — до аминокислот. Процесс дыхания обычно характеризуется интенсивностью дыхания (м
3/кгс), определяемой следующим образом:
K=V/mt, (1)
где V — объем выделенного углекислого газа или поглощенного кислорода, м
3; т — масса цветов, кг; t — время, с.
Интенсивность дыхания можно характеризовать, как иногда делается, массой выделенного СО
2 (в мг) за единицу времени, отнесенной к массе цветов.
В процессе дыхания энергия солнечного света, запасенная при фотосинтезе в различных органических веществах, высвобождается и используется на поддержание жизнедеятельности. Дыхание представляет собой аэробный окислительный распад органических соединений на простые, неорганические, сопровождаемые выделением энергии.
Если субстратом дыхания служат сахара (С
6Н
12О
6), происходящие реакции окисления приводят к выделению воды и углекислого газа. При этом выделяется определенное количество тепла (2824 кДж на 1 грамм-молекулу глюкозы), что необходимо учитывать при холодильном хранении цветов. Для характеристики дыхания используют также дыхательный коэффициент, который представляет собой отношение выделенного объема углекислого газа к поглощенному объему кислорода:
δ — V
1/V
2, (2)
где V
1 и V
2 — объемы соответственно поглощенного кислорода и выделенного углекислого газа, м
3.
В зависимости от преимущественного использования тех или иных веществ в качестве субстрата дыхания могут возникать изменения величины дыхательного коэффициента. Если дыхательным субстратом служат сахара типа глюкозы, дыхательный коэффициент равен единице.
Когда роль субстрата играют липиды, белки и другие соединения с высокой степенью восстановления, дыхательный коэффициент оказывается меньше единицы. Для субстратов с более низкой, чем у Сахаров, степенью восстановления дыхательный коэффициент больше единицы, например при окислении щавелевоуксусной кислоты или других кислот.
Определив дыхательный коэффициент срезки цветов путем параллельного измерения содержания СО
2 и О
2, можно получить представление о степени окисления расщепляемых соединений, что характеризует состояние срезки. Не вся энергия, освобождаемая при дыхании, расходуется в процессах жизнедеятельности. Растительный организм использует в основном ту энергию, которая запасена в молекулах аденозинтрифосфата (АТФ). Она расходуется на процессы синтеза белков, нуклеиновых кислот и других важных органических соединений, на процессы поступления и передвижения питательных веществ и воды. Большая часть энергии, не запасенной в АТФ, рассеивается в виде тепла.
Таким образом, дыхание срезки представляет собой сумму обратимых и необратимых реакций, в процессе которых выделяется углекислый газ и поглощается кислород, что сопровождается реакциями распада одних и образованием других соединений. Пока не установилось равновесие, скорости этих реакций будут изменяться. Эти изменения носят в общем сопоставимый характер даже для очень разных видов декоративных растений. Зависимость дыхания от времени бывает сходной, различаясь лишь масштабом времени, наблюдается последовательная смена фаз дыхания (табл. 1).

1. Различные фазы интенсивности дыхания
Изменения интенсивности выделения СОг связаны с внешними изменениями цвета листьев. В течение первой и второй фаз эта связь мало заметна, но в начале третьей фазы происходит потеря пигмента. Зеленая окраска листьев бледнеет и переходит в желтую. Затем листья приобретают красноватую окраску из-за окисления содержащихся в клетках полифенолов. У растений, не содержащих полифенолов, листья становятся прозрачными и серыми вследствие утечки сока из разрушающихся клеток в межклетники.
Подъем дыхания в шестой фазе связан с наступлением так называемого климактерического периода, который характеризуется разрушением белков и возрастанием окислительной активности митохондрий. В постклимактерический период биосинтетические процессы прекращаются, возрастают процессы распада. Происходит распад митохондрий и других клеточных структур, нарушается энергетический обмен, растение окончательно погибает.
Интенсивность дыхания розы в срезке гораздо ниже, чем на материнском растении, причем это снижение доходит до 50 %. Такое снижение наблюдается в течение трех дней, затем происходит некоторый подъем интенсивности дыхания. Характерно, что лепестки розы имеют значительно большую интенсивность дыхания, чем цветок целиком. Интенсивность дыхания лепестков возрастает перед раскрытием бутона, достигая максимума при полном раскрытии цветка, после чего наблюдается уменьшение этого показателя. В общем балансе дыхания на долю лепестков срезки розы приходится около 80 %.
Срезанные цветы с большой интенсивностью дыхания хранятся гораздо хуже срезки с небольшим значением этой величины. Поэтому задача технологии хранения состоит в том, чтобы уменьшить интенсивность дыхания. При этом небольшой запас питательных веществ, которым обладает цветок, сохранится в течение более длительного времени. То же относится и к другим органам цветочных растений, предназначенных для хранения, — черенкам, семенам, луковицам, клубнелуковицам.
Один из наиболее эффективных и традиционно используемых методов снижения метаболических процессов и уменьшения интенсивности дыхания — холодильное хранение. При правильном выборе режима можно резко уменьшить расход запасенных веществ в срезке цветов. Так, снижение температуры с 15 до 4 °C вызывает уменьшение интенсивности дыхания срезанных цветов розы в 3 раза.
Дыхание растений определяется диффузией кислорода в растительные клетки и в некоторых случаях может иметь место даже при отрицательных температурах. Однако для большинства декоративных культур дыхательные процессы резко тормозятся при температуре, близкой к 0 °C. При такой температуре происходят изменения в протоплазме, которые могут привести к гибели растительных клеток, гибель может быть и следствием приостановки дыхания. В связи с этим часто бывает весьма трудно установить причину гибели растения при пониженных температурах. Поэтому нижняя допустимая температурная граница для некоторых цветов лежит существенно выше нуля, достигает 3–5 °C (срезка гладиолуса) и даже 10 °C (орхидея).
Максимальная интенсивность дыхания для большинства декоративных растений отмечена при температуре 30–35 °C, причем наблюдается и четко выраженная зависимость от времени: интенсивность дыхания снижается на протяжении достаточно длительного временного интервала.
Величина дыхательного коэффициента также варьирует при изменении температуры. При понижении температуры возрастает растворимость кислорода в клеточном соке, что сказывается на диффузии этого газа в растительные ткани. Ярко выраженную температурную зависимость имеет и активность многих ферментов, участвующих в дыхании, что связано с окислением тех или иных субстратов. Изменение дыхательного коэффициента при понижении температуры у разных растений неодинаково. Обычно величина дыхательного коэффициента у цветов приближается к единице и мало изменяется с течением времени хранения. В качестве дыхательного субстрата используются в основном сахара, но при отцветании или перезревании субстратом биологического окисления становятся и белки, что может привести к снижению дыхательного коэффициента до 0,5.

Хранение черенков и цветов в присутствии поглотителя этилена
Один из методов снижения интенсивности дыхания цветочной срезки, а значит, и продления сроков ее хранения — это уменьшение концентрации кислорода в хранилище или упаковке. Окисление органических субстратов при дыхании связано с диффузией кислорода в растительные ткани. Последняя определяется парциальным давлением кислорода, зависящим от концентрации этого газового компонента. В диапазоне объемных концентраций от 0 до 10 % интенсивность дыхания возрастает, но этот рост не всегда имеет линейный характер. Прямая пропорциональность отмечена в более узком диапазоне концентраций — 0–5 %.
Проникновение кислорода в глубь растительных тканей зависит и от морфологических свойств органов растений. В основном газообмен срезки происходит через устьица, на внешний покров — кутикулу приходится лишь небольшая его часть. Там, где отсутствуют устьица, например у семян, луковиц, газообмен идет через толстую кутикулярную оболочку постепенно и зависимость поглощения кислорода имеет вид прямой. Отклонения от прямой линии в сторону большего (гиперболического) роста интенсивности дыхания с повышением концентрации кислорода свидетельствуют о том, что, начиная с некоторых пороговых величин, концентрация кислорода перестает быть единственным фактором, ограничивающим дыхание, и начинает проявляться влияние других факторов: концентрации дыхательных субстратов, активности ферментного аппарата и т. п. Кроме того, передвижение кислорода в растительном организме может происходить не только диффузионным путем.
Для проведения расчетов, связанных с установлением газового режима в хранилищах, контейнерах, упаковках с цветочной продукцией, в особенности для режимов, характеризующихся относительно малой концентрацией кислорода (3–5 °C), можно принять линейную зависимость интенсивности дыхания [м
3/(кгс)] от концентрации кислорода:
К — K
0V
1/V, (3)
где K
0 — интенсивность дыхания в обычной атмосфере (21 % O
2), м
3/кгс; V
1, V — соответственно первоначальный и текущий объемы кислорода, м
3.
Выделяющийся в процессе дыхания углекислый газ также оказывает определенное влияние на интенсивность дыхания. Возрастание концентрации этого газа приводит к некоторому снижению интенсивности дыхания, но этот эффект проявляется лишь при относительно больших значениях содержания СO
2. Как углекислый газ, так и различные углеводороды блокируют активность ферментов биологического окисления.
На процессы дыхания в значительной степени влияет и водный режим растений. Интенсивность дыхания созревающих семян уменьшается по мере уменьшения их влагосодержания, и сухие семена, луковицы, клубнелуковицы дышат относительно слабо, так как находятся в состоянии физиологического покоя. Добавление влаги выводит их из этого состояния, что сопровождается возрастанием интенсивности дыхания. Иная картина наблюдается при подсыхании срезки цветов. Сначала интенсивность дыхания повышается, после чего она снижается до уровня более низкого, чем вначале. Если потеря влаги не вызвала необратимого повреждения тканей цветка, то дыхание может стабилизироваться на таком более низком уровне. Если затем срезка будет обеспечена достаточным количеством воды, то дыхание может возвратиться к исходному уровню, при условии что пониженная влажность, которая часто бывает при так называемом сухом хранении, не привела к падению влагосодержания ниже критической величины. В противном случае возобновление водоснабжения уже не восстанавливает нормальное дыхание, происходит дальнейшее разрушение клеточных структур, и растение гибнет.
При изменении содержания влаги дыхательный коэффициент может изменяться в разные стороны, что связывают с неодинаковой чувствительностью различных ферментов к влаге и с возможными субмикроскопическими изменениями клеточных структур, определяющими диффузию дыхательных субстратов. Помимо этого, влагосодержание влияет на проницаемость клеточных мембран для разных газовых компонентов.

Рассмотрим пример пересчета. Известно, что лепестки розы имеют интенсивность дыхания 500 мг СО
2/(кгч). Необходимо выразить эту величину в м
3/(кг•с). С учетом приведенного выше соотношения получим: К = 1,41•10
-10•500 =7,05•10
-8, м
3/(кг•с). Это значение соответствует также 70,5 мкл/(кг•с). В таблице 2 приведены данные об интенсивности дыхания черенков и срезки некоторых цветов.
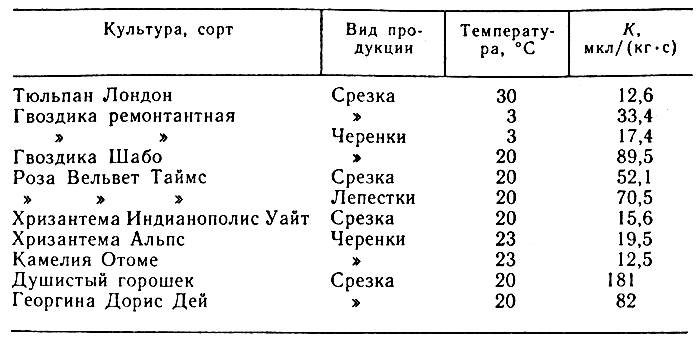
Таблица 2. Интенсивность дыхания цветов и черенков
ТРАНСПИРАЦИЯ
Вода — главный компонент живых растительных клеток, на ее долю приходится до 90 % сырой массы. В зрелых растительных клетках большая часть воды содержится в крупной центральной вакуоли (Гэлстон, 1983), которая плотно прижимается к клеточной стенке, способствуя поддержанию формы клетки в мягких органах растения (листьях, стеблях, побегах). Форма декоративных травянистых растений зависит от гидростатических сил, при ослаблении последних вследствие потери влаги возникают утрата тургора и увядание. Если процесс увядания, например при сухом хранении срезки, не зашел далеко, при получении влаги запас воды в вакуоли возобновляется, тургор восстанавливается. Растения за счет специальных механизмов саморегуляции способны поддерживать свою оводненность на постоянном уровне, непрерывно поглощая воду и испаряя ее.
Транспирация представляет собой выделение растением водяного пара в атмосферу в основном посредством листьев и лепестков. Вода испаряется с поверхности влажных клеток, диффундирует по межклетникам и выходит наружу через открытые устьица либо кутикулу. Способность воды диффундировать, испаряться или поглощаться оценивают величиной водного потенциала, имеющего размерность давления. В отсутствие противодавления клеточной стенки поступление воды в клетку определяется водным потенциалом клетки, первоначально равным осмотическому потенциалу раствора, заполняющего вакуоль. С проникновением воды в вакуоль объем последней увеличивается, а раствор становится более разбавленным. Цитоплазма прижимается к стенке клетки, возникает противодавление клеточной стенки на клеточное содержимое. Когда противодавление клеточной стенки достигает достаточно большой величины, устанавливается динамическое равновесие, и приток воды прекращается.
Водный потенциал клетки определяется суммой потенциала давления и осмотического потенциала, который всегда отрицателен. Потенциал давления в живых клетках положителен. Клеточный потенциал равен нулю (при полном тургоре) или отрицателен при потере влаги и тургора. Если потенциал давления или тургорный потенциал упал до нуля, лист полностью завядает. Поэтому о завядании и потере влаги листьями и лепестками обычно судят по легко измеряемой величине водного потенциала соответствующих клеток (см. главу 8).
Интенсивность транспирации зависит от температуры и влажности воздуха, ширины раскрытия устьичных щелей, числа устьиц, облиственности срезки и разности водных потенциалов воздуха внутри и снаружи листа. Обычно вода из межклетников диффундирует в более сухой атмосферный воздух, и продолжительность сохранения срезки цветов в свежем состоянии определяется тем, как обеспечен транспорт к цветку воды и метаболитов, необходимых для поддержания жизнедеятельности.
В срезке цветов передвижение веществ по цветоносу отличается от аналогичного процесса на материнском растении, поскольку цветонос с цветком отделен от корней и частично листьев. Избыток воды, куда погружен цветонос, не может компенсировать активности корневой системы, обеспечивающей поступление веществ из почвенного раствора и веществ, синтезированных корневой системой, в том числе различных метаболитов и гормонов. Срезанный цветок в лучшем случае может использовать лишь то, что растворено в питающей его воде, засасываемой через срез цветоноса вследствие транспирации. Некоторые растворенные вещества, в частности сахара, адсорбируются плазматическим содержанием ситовидных трубок флоэмы, как это происходит и при движении синтезированных самим растением метаболитов. Вода перемещается по сосудам ксилемы цветочного побега, а тургор цветка и побега зависит от содержания в них воды.
Цветы различного анатомического строения, с неодинаковой сосудистой системой должны различаться и по срокам жизни в вазе. К числу наиболее устойчивых к завяданию в срезке декоративных растений относится тюльпан, наименее устойчивых — георгина. Промежуточное положение занимает душистый горошек. Гидравлическая характеристика сосудистой системы срезанных цветов определяется следующими факторами: отношением общей площади сосудов ксилемы к площади поперечного сечения стебля; средним количеством сосудов на один срез и на единицу площади срезки.
Существует прямая зависимость между способностью срезанного цветочного побега транспортировать воду и количеством сосудов в стебле, в то время как величина поперечного сечения сосудов (диаметр) играет прямо противоположную роль. У тюльпана средний диаметр сосудов меньше, но число их больше; у георгины — наоборот. Душистый горошек занимает промежуточное положение. Срезка тюльпана обладает наибольшей способностью к быстрому и полному восстановлению тур-гора, в то время как георгины даже после незначительного снижения тургора восстанавливают его с трудом, а при сильной потере тургора вообще не могут возвратиться в тургосцентное состояние, хотя сосуды георгины занимают примерно в 3 раза большую площадь, чем сосуды тюльпана. Более узкие и многочисленные сосуды ксилемы тюльпана обеспечивают лучшее водоснабжение цветка и стебля за счет капиллярных сил, величина которых тем больше, чем меньше диаметр трубок ксилемы.
Водный стресс в срезке обычно рассматривают как причину быстрого увядания вследствие закупорки проводящих сосудов стебля, которая может возникать в результате деятельности микроорганизмов либо под влиянием различных физиологических факторов. Баланс воды поэтому — один из главных факторов продолжительности жизни срезанных цветов. Со временем наблюдается снижение поглощения воды растением, сопровождающееся и уменьшением транспирации.
На рисунке 1 представлены кривые изменения транспирации и поглощения воды срезкой розы. Изменения в характере транспирации срезки роз сопровождаются изменением массы цветка. Причем это изменение неодинаково для цветов с длительным сроком жизни (роза Супер Стар) и более коротким (Голден Вэйв). В первые два дня наблюдается увеличение массы цветков и того и другого сорта, причем розы Супер Стар еще три дня сохраняют повышенную массу и лишь затем наблюдается ее снижение до уровня, все-таки превосходящего начальный. Поглощение воды превосходит транспирацию в течение первых пяти дней, затем эти показатели выравниваются и спустя примерно два дня транспирация начинает превосходить поглощение воды. Розы Голден Вэйв теряют массу начиная с третьего дня и уже на четвертый день их масса становится меньше первоначальной. Величины поглощения воды и транспирации монотонно снижаются в течение всего периода наблюдений. Измерения водопроницаемости (гидравлической проводимости) сосудистых каналов стебля указывают поначалу на резкое, а затем постепенное уменьшение этой величины для обоих сортов роз. Спустя 100 ч проводимость составляет около 0,2 первоначальной. Необходимо отметить, что проводимость сосудистой системы у свежесрезанных цветов не зависит от развития и возраста цветка.

Рис. 1. Водопоглощение и транспирация срезки розы: 1 — транспирация; 2 — водопоглощение
Водный потенциал лепестков резко уменьшается спустя примерно шесть дней, чем и определяется продолжительность жизни цветов в вазе. Такое снижение водного потенциала происходит не вследствие естественного старения, поскольку непосредственно на вегетирующем растении уменьшения водного потенциала в течение того же времени не наблюдается. Раннее старение цветочной срезки вызывается развитием водного стресса, ведушего к снижению соответствующего потенциала, причем этот процесс происходит более быстро у сортов с коротким периодом жизни.
Закупорка сосудов — основная причина увядания и старения срезанных цветов, что подтверждается снижением гидравлической проводимости стебля, одинаковым для обоих сортов. Это снижение проводимости нельзя связать с естественным старением, поскольку у вегетирующего растения она не изменяется, уменьшение проводимости происходит в результате отделения цветка от материнского растения.
Повышение со временем ферментной активности у срезанных цветов прямо указывает на то, что закупорка сосудов связана с этим явлением, а не только с активностью микрофлоры. Под влиянием ферментов происходит гидролиз стенок клетчатки, выстилающих сосуды, их гидравлическое сопротивление увеличивается. Поэтому один из возможных способов продления срока жизни срезанных цветов — инактивация ферментов.
Характерно, что как повышение ферментной активности, так и снижение проводимости сосудистой системы примерно одинаково и для цветов с коротким, и с длинным периодами жизни в вазе. Различие в этих сроках можно объяснить исходя из водного баланса в срезке, определяемого количеством поступившей воды и воды, потерянной цветком в результате транспирации. У цветков с коротким периодом траспирация выше, водный потенциал ниже, что и приводит к более раннему увяданию. Эта разница в транспирации — следствие различной способности устьиц реагировать на стрессовую ситуацию. На материнском растении раскрытие устьиц одинаково для обоих сортов, но после срезки раскрытие устьиц у короткоживущего сорта Голден Вэйв больше. Если удалить у срезки все листья, то разница в потерях влаги и продолжительности жизни нивелируется. К этому же приводит и обработка специальными препаратами, вызывающими закрытие устьиц.
Тем не менее объяснить разницу в сроках жизни лишь на основе механизма, регулирующего транспирацию путем открытия устьиц, невозможно. Большую роль в этом играет и активность различных метаболитов. Увядание поставленных в воду цветов происходит значительно быстрее, чем тех же цветов на материнском растении, хотя по обеспеченности водой они могут быть сопоставимы. Это увядание связано с уменьшением Сахаров. в тканях цветов, поскольку добавление в воду сахарозы или глюкозы увеличивает срок жизни цветов примерно вдвое. Такие результаты были получены в опытах с луковичными растениями — тюльпаном, нарциссом и гиацинтом и с другими декоративными растениями — сиренью, душистым горошком.
Содержание воды в цветках душистого горошка в вазе на второй и третий день было выше, чем в цветках на растении. Затем содержание воды в них резко упало, и цветы завяли. Аналогичная картина отмечена и у тюльпана, причем одновременно происходило снижение интенсивности дыхания.
Таким образом, положительное влияние на продление срока жизни в воде таких цветов, как тюльпан, нарцисс, гиацинт, ландыш, душистый горошек, оказывают вещества, повышающие или стабилизирующие интенсивность дыхания.
Иначе обстоит дело с транспирацией и передвижением воды у декоративных растений, цветы или соцветия которых быстро теряют тургор после срезки (даже если их незамедлительно помещают в воду), хотя на материнском растении они держатся долго. Характерный представитель этой группы растений — георгина. Увядание соцветий у нее связано с постепенной закупоркой сосудов, увеличением их гидравлического сопротивления, что приводит к нарушению транспирации и обезвоживанию тканей цветка. Это, в свою очередь, ведет к нарушению ферментативного равновесия и гидролизу белков плазмы вплоть до гибели растения. Интенсивность дыхания цветков георгины в вазе снижается резко и лишь при увядании отмечается климактерический подъем дыхания. Добавление в воду сахарозы или глюкозы не влияет на продолжительность жизни
в вазе цветов георгины, но зато большое влияние оказывают вещества, способствующие передвижению по сосудам и препятствующие их закупорке (сернокислый алюминий, окисное сернокислое железо и некоторые другие).
Следовательно, различные виды декоративных растений нуждаются в специфических веществах для продления срока жизни в вазе. Растения с высокой интенсивностью дыхания для поддержания ее на должном уровне и цветы, интенсивность дыхания которых в вазе быстро падает, испытывают потребность в сахарах. На растения, сосудистая система которых имеет тенденцию к закупорке, положительное влияние оказывает введение в воду веществ, способствующих лучшему передвижению питательного раствора в тканях цветка.
Применение одних и тех же веществ, рекомендуемых для продления срока жизни цветов в вазе, в одних случаях дает положительный эффект, в других — никакого, в подчас получают даже отрицательный результат. Более того, в одних местностях срезка в обычной воде стоит дольше, чем в других, что указывает на различное качество воды в отдельных регионах. Смягчение жесткой воды с помощью соды, как правило, приводит к ухудшению условий содержания срезки гвоздики — длительность жизни цветов в вазе снижается. Качество воды оказывает влияние и на раскрытие бутонов гвоздики, срезанной в период полуроспуска, повышенное содержание минеральных солей в воде задерживает этот процесс. Растворенные в воде фторсодержащие соединения могут вызвать некроз лепестков и листьев срезки гладиолуса. Некоторые цветы имеют особое анатомическое строение стебля, представляющего собой полую трубку, в стенках которой располагаются проводящие сосуды. Такое строение имеют цветы герберы (рис. 2), у которой потеря декоративных качеств выражается в «поникающей головке», то есть в потере тургора стеблем при относительно свежем цветке. Измерение водного потенциала лепестков у поникших цветков показало, что он достаточно высок и близок к потенциалу незавядшей срезки герберы, в то время как стебель испытывает явный водный стресс (его влагосодержание сильно уменьшилось), по-видимому, лепестки герберы обладают способностью отбирать воду от стебля.

Рис. 2. Строение стебля герберы: 1 — полость в стенке цветоноса; 2 — полость внутри цветоноса; 3 — вода вазы
Водный баланс герберы складывается из водопоглощения и транспирации. После срезки транспирация остается примерно на том же уровне, а водопоглощение монотонно падает. Последнее определяется градиентом водного потенциала и гидравлическим сопротивлением на дистанции ваза — лепестки. Уменьшение водопоглощения может быть вызвано как снижением градиента потенциала, так и увеличением гидравлического сопротивления. Поскольку градиент потенциала изменяется незначительно, уменьшение водопоглощения связано с увеличением гидравлического сопротивления, что отмечено и для некоторых других цветов, например розы.
Чтобы предотвратить потери тургора стеблем, можно использовать различные химические вещества, имеющие бактерицидное действие. Эти вещества предотвращают и микробиологическую закупорку сосудов ксилемы, блокируя прямой водный транспорт. Однако, если вода попадает в полость стебля, возможен косвенный транспорт ее через ткани стенки стебля. Поэтому для цветов, имеющих такое же строение стебля, как у герберы, на некотором расстоянии над поверхностью воды в вазе нужно сделать небольшое отверстие в стебле для выпуска воздуха. В этом случае срезанные цветы стоят на 5—10 дней дольше.
Водопоглощение в срезанных цветах зависит также от неразрывности водного пути между вазой и растением, который может блокироваться воздушными тромбами в проводящих сосудах ксилемы. Эти воздушные тромбы обычно возникают в виде небольших пузырьков на стенках или в углублениях сосудов, и для хорошей сохранности срезки необходимо как можно быстрее восстановить целостность транспортирующих потоков ксилемы.
При срезывании цветоносов вода выдавливается из кончика срезанного стебля и образуется воздушный тромб, величина которого зависит от водного потенциала цветка до срезывания и интенсивности транспирации после этого. Наличие таких тромбов препятствует нормальной транспирации, водный поток устремляется в обход тромба через ткани, окружающие сосуды ксилемы, что увеличивает гидравлическое сопротивление в десятки раз. Повторная обрезка стебля под водой устраняет воздушную блокировку сосудистых пучков ксилемы. Аналогичный результат дает и добавление в воду, где находится срезка цветов, некоторых подкисляющих, смачивающих или поверхностно-активных веществ, способствующих рассасыванию воздушных тромбов. Если вследствие закупорки сосудов вода не может подниматься по стеблю, для облегчения тока воды по сосудистой системе можно использовать устройство, подающее воду в срезку под давлением. Подробно этот метод рассмотрен в главе 3.
Водный поток через ксилему, гидравлическая проводимость ее сосудов и транспирация взаимосвязаны. Объемный расход (м
3/с) воды через сосуды ксилемы можно определить по формуле
Q — PPS, (4)
где р — гидравлическое давление в сосудах ксилемы, Па; Р — гидравлическая проводимость; S — площадь поперечного сечения сосудов, м
2.
Отсюда следует, что транспирационный поток при прочих равных условиях зависит от проводимости сосудов ксилемы. Поскольку водный ток обеспечивает связь между стеблем и цветком, весьма важно не допустить блокировку сосудов ксилемы, повышения ее гидравлического сопротивления, чтобы не уменьшить насыщенность водой (тургор) лепестков и предотвратить быстрое увядание. Следует также иметь в виду, что транспирационный ток воды обеспечивает протекание процессов обмена, связь срезки с питательным раствором вазы. Жизнь срезанных цветов в вазе будет тем продолжительнее, чем лучше работает транспирационный ток ксилемы, дающий срезке необходимое количество влаги.
Количественно транспирацию оценивают величиной потока, отнесенного, как правило, не к площади сосудов ксилемы, поскольку эта величина трудно определима, а к площади поверхности листа или листьев. Такое определение транспирации дает возможность проводить сопоставимый анализ движения воды в сходных растениях. При этом, однако, возможны систематические ошибки, поскольку не всегда поверхности испарения сопоставимы друг с другом: устьица могут располагаться как с одной, так и с обеих сторон листа и т. д. Кроме того, точное определение площади листьев также представляет трудности.
Для того чтобы возместить потери воды срезкой при испарении, расход воды на испарение должен соответствовать приходу, зависящему от транспирационного потока через сосуды ксилемы. При отсутствии такого баланса например в результате закупорки части сосудов, может возникнуть водный дефицит, вызывающий физиологические расстройства срезки и ее гибель.
ФИТОГОРМОНЫ И ЭТИЛЕН
Завядание цветка как на материнском растении, так и в срезке — одна из форм старения растительных тканей. Между старением растительных тканей и содержанием в них ауксинов и ингибиторов роста имеется определенная связь. Опадение бутонов, иногда наблюдаемое в срезке, вызывается нарушением баланса между ауксинами и ингибиторами, и в стареющих тканях происходит замедление передвижения ауксинов и цитокининов. Продление жизни срезанных цветов в вазе до тех же сроков, что и в естественных условиях на материнском растении, возможно при добавлении к воде со срезкой сахарозы или глюкозы, стабилизирующих дыхание и метаболические процессы в растении. Большая роль в этом процессе принадлежит регуляторам роста, в частности эндогенным ауксинам и хлорогеновой кислоте, что было подтверждено опытами со срезкой тюльпанов, находящихся в дистиллированной воде и в 6 %-ном растворе сахарозы.
Вначале, при появлении окраски в бутонах (первый день), количество ауксинов в околоцветнике и пестике одинаково как в срезке, так и в цветках на растении. Затем вместо характерного для материнского растения резкого возрастания количества ауксинов наблюдается противоположное явление — снижение их содержания. При этом уменьшение количества ауксинов остается необратимым. Добавление к воде сахарозы вызывает (по сравнению со срезкой в чистой воде) повышение содержания ростактивирующих веществ, снижение количества ингибиторов роста. Это задерживает завядание — околоцветник в варианте с чистой водой осыпается к восьмому дню, в то время как у цветков в растворе сахарозы остается свежим, сохраняя свои декоративные качества. Действие сахарозы связано с увеличением интенсивности дыхания цветка, способствующим повышению уровня его жизнедеятельности, направленной на усиление синтеза ауксинов при снижении синтеза ингибиторов. Такое изменение между регуляторами роста интенсифицирует перемещение в срезанный цветок метаболитов, еще сохранившихся в тканях цветочного побега.
Аналогичная картина наблюдается и в отношении кинетики содержания ингибитора некоторых ферментов — хлорогеновой кислоты. Добавление сахарозы способствует усилению синтеза хлорогеновой кислоты, что изменяет соотношение между регуляторами роста, приближая состояние срезанного цветка к физиологическому его состоянию на растении.
К фитогормонам, вырабатываемым как здоровыми клетками растений, так и в особенности клетками, подвергшимися физиологическому разрушению, относится этилен. Известно, что одно гнилое яблоко в контейнере вызывает порчу остальных. Это связано с тем, что в нем вырабатывается летучий газ — этилен, вызывающий разрушительные изменения в соседних здоровых плодах. Плоды портятся и, в свою очередь, начинают выделять этилен, в результате чего возникает цепная реакция порчи.
Среди эндогенных регуляторов метаболических процессов, таких как созревание плодов или опадение листьев, этилен вследствие его летучести занимает особое место. В отличие от других гормонов транспорт этилена не требует каких-то специализированных механизмов и осуществляется практически беспрепятственно. Чтобы устранить избыточное количество фитогормонов, нет нужды и в специальных системах инактивации — газ выводится в окружающее пространство. Некоторые проблемы возникают лишь тогда, когда это пространство ограниченно, например объем хранилища. Такое своеобразие свойств этилена обусловило довольно позднее признание его в качестве регулятора метаболических процессов, а не как сопутствующий этим процессам побочный продукт.
Этилен — ненасыщенный углеводород (С
2Н
4), представляет собой бесцветный газ с запахом, напоминающим запах диэтилового эфира. Этилен легко вступает в реакцию с галогенами, водой, серной кислотой, легко окисляется кислородом, озоном, перманганатом калия. Способность этилена инактивироваться под воздействием окислителей имеет большое значение в технологии хранения плодов, овощей, цветов. Добавление марганцовокислого калия в герметизированный контейнер предотвращает накопление этилена и порчу срезки цветов или посевного материала (семена, луковицы, клубнелуковицы и т. п.). Этой же цели служит и обработка озоном с помощью, например, барьерного разряда (см. главу 3).
Для этилена характерна высокая активность при очень малых концентрациях (единицы или десятки мкл/л). Выявление этилена в таких концентрациях возможно лишь чувствительными методами хроматографического анализа.
Определенным антагонистом этилена служит углекислый газ, причем соотношение между этими компонентами таково. Чтобы нейтрализовать активность одной молекулы этилена, необходимо 105 молекул углекислого газа. Хранение цветов в модифицированной среде, обогащенной углекислым газом, дает возможность нейтрализовать действие продуцируемого растениями этилена, если концентрация углекислого газа достаточно высока. Этилен способен быстро перемещаться по клеточным тканям и свободному межклеточному пространству — при обработке этиленом одного листа его активность быстро проявляется во всех органах растения. Перемещение этилена происходит практически беспрепятственно, с чем и связана его способность выполнять функции посредника в процессах метаболизма с участием фитогормонов.
Этилен вызывает старение клеток, тканей и органов, тормозит деление клеток. Весьма велика роль этилена, индуцированного повреждением растения. Такой стрессовый этилен образуется при экстремальных температурных воздействиях, ухудшении водоснабжения, при заболеваниях, вызванных бактериями и грибами, при механических травмах, поскольку стрессовый этилен способствует отторжению поврежденных тканей и органов.
Инактивация как эндогенного, так и стрессового этилена имеет большое значение в технологии хранения. Как срезка, так и материал для размножения растений (семена, луковицы, клубни) выделяют этилен, ускоряющий созревание и сокращающий сроки хранения. Повышение концентрации углекислого газа и снижение содержания кислорода способны резко замедлить синтез этилена. Этим путем можно обспечить более продолжительное хранение срезки и семенного фонда, особенно в условиях пониженных температур.
Физиологическое действие этилена определяется тремя главными факторами: концентрацией, длительностью воздействия и температурой. Иногда целесообразно рассматривать воздействие дозы этилена, которая представляет собой произведение концентрации на продолжительность его действия во времени. Такой подход наиболее удобен при изучении действия этилена на срезку цветов, например гвоздики (Barden, 1972). На рисунке 3 представлена зависимость относительного срока хранения срезки гвоздики Уайт Сим от дозы этилена. Предварительно было установлено, что этилен обладает кумулятивным действием — один и тот же эффект увядания наблюдается при концентрации 0,4 мкл/л в течение 10 ч и 0,04 мкл/л в течение 100 ч.

Рис. 3. Влияние этилена на сроки хранения гвоздики Уайт Сим: сплошная линия — срезка; пунктирная — черенки
Анализ кривых, приведенных на рисунке, свидетельствует о том, что гвоздика в бутонах лучше сопротивляется действию этилена, чем распустившиеся цветы. Весьма существенно и действие температуры. Раскрывшиеся цветки гвоздики в 1000 раз более чувствительны к этилену при повышении температуры с 1,7 до 21 °C. Гвоздика в полуроспуске в 10 раз более чувствительна к действию этилена при повышении температуры с 10 до 21 °C.
Какова же предельно допустимая концентрация этилена с точки зрения технологии хранения? Очевидно, что ответ на этот вопрос связан с предельно допустимой нормой отхода срезки при хранении. Считается, что эта величина составляет примерно 20 %. Тогда можно получить зависимость между дозой действия этилена и температурой, соответствующей данной величине потерь (20 %). При температуре 4 °C предельно допустимая доза для раскрытых цветков будет примерно 10 мкл/л в час. При более высоких температурах эти предельно допустимые дозы быстро уменьшаются.
Для расчетов холодильных камер необходимо располагать сведениями о количестве этилена, продуцируемого цветами. Приводим данные исследователя Фан Кхон Тона о количестве этилена (мкл/кг в сутки), выделяемого срезкой цветов при 20 °C:

МИКРОФЛОРА СРЕЗАННЫХ ЦВЕТОВ
Растения могут поражаться бактериями, грибами и прочими патогенами, находящимися во внешней среде. В процессе эволюции, для того чтобы выжить, у растений вырабатывались различные защитные механизмы, инактивирующие действие микрофлоры или отпугивающие патогенов. Дикорастущие формы лучше приспособлены к влиянию внешней среды, в то время как у культурных декоративных растений, выведенных человеком, такие защитные механизмы часто ослаблены или отсутствуют. Для защиты от потенциальных вредителей и болезней у растений имеются разные приспособления — структурные, физические, химические. Последние служат главным оружием против патогенов.

Хранение цветов в присутствии поглотителя этилена
Многие болезни растений, в том числе и срезки цветов, вызываются паразитарными грибами. Инфекция возникает, если спора одного из таких мелких бесцветных нитевидных организмов внедряется в поверхностную структуру растений. Гифы грибов проникают в растительные клетки, из которых гетеротрофные грибы получают питательные вещества. В результате растение заболевает, что связано как с повреждением клеток, так и с действием грибных токсинов. Растения имеют защиту от таких поражений, о чем, в частности, свидетельствует избирательная их поражаемость. Определенный вид грибов поражает и определенные виды растений, в то время как остальные оказываются устойчивыми к его действию. Более того, среди определенного вида растений, например гвоздики, встречаются сорта, устойчивые к действию грибов (например, Botrytis), обычно поражающих этот вид. Такая устойчивость может быть обусловлена различными факторами: структурой (толстая покровная ткань — кутикула) или химическим составом, когда для инактивации паразитарной микрофлоры служат компоненты из числа вторичных метаболитов. Срезка цветов имеет открытую рану в месте разреза стебля, лишена притока метаболитов и является особо удобной мишенью для поражения паразитарной микрофлорой, вследствие чего срезка нуждается в специальной защите.
Болезни срезки могут быть вызваны также различными бактериями. Бактерии обитают как в воде вазы и непосредственно на поверхности растений, так и в контейнерах и таре, предназначенной для хранения и транспортировки цветочной продукции. Бактерии могут подниматься вверх по стеблю цветов и образовывать скопления, закупоривающие сосуды стебля. На срезке цветов обнаруживают бактерии, встречающиеся обычно в почве (род Pseudomonas), воде (микрококки), воздухе (те же микрококки и ахромобактерии), и такие повсеместно распространенные виды, как кишечная палочка. Некоторые виды бактерий легко инактивируются антибиотиками или другими препаратами, обезвреживание других связано с серьезными трудностями.
Наличие бактерий и микроскопических грибов не обязательно приводит к закупорке проводящих сосудов ксилемы, такие нежелательные последствия вызывают лишь некоторые роды, например Pseudomonas и Achromobacter. Часто блокирующее действие микрофлоры связывают с продуктами метаболизма бактерий, токсичными для растений и вызывающими распад тканей, выстилающих проводящие пучки.
Популяции бактерий в воде вазы с цветами имеют тенденцию к быстрому росту. За короткий период (24 ч) число бактерий возрастает до 10
6 клеток/мл — это типичный уровень бактериальной обсемененности. Наибольшая плотность бактерий составляет около 10
9 клеток/мл. При таких концентрациях наблюдается физическое разложение стебля и увядание цветов, вода в вазе приобретает гнилостный запах.
Степень бактериального поражения определяется штаммами микроорганизмов, числом цветов, приходящихся на единицу объема воды в вазе, наличием или отсутствием питательных веществ (сахарозы) и ингибиторов жизнедеятельности бактерий, среди которых особенно эффективным оказалось производное лимонной кислоты, известное под названием 8-оксихинолин цитрат (8HQC).
На растениях гвоздики были идентифицированы четыре группы микроорганизмов рода Achromobacter, которые можно было выращивать на агаровой среде. Оказалось, что длительность жизни цветов гвоздики в вазе и гидравлическое сопротивление стебля зависят от бактериальной обсемененности. Однако снижение срока жизни цветов гвоздики в вазе связано не столько с самими микроорганизмами, сколько с метаболитами, ими вырабатываемыми. Косвенным подтверждением этого служат опыты с бактерицидными препаратами, не вызывающими существенного увеличения срока жизни цветов в вазе.
Физиологическая закупорка проводящих сосудов в срезке розы развивается на 2—3-й день и постепенно возрастает, что сопровождается накоплением пектиновых веществ. Установлено, что такая микробиологическая блокировка возникает первоначально на высоте 2–5 см над поверхностью воды. Образующиеся в сосудах растения пробки состоят из продуктов разложения пектиновых веществ (результат воздействия ферментов и метаболитов микроорганизмов, перемещающихся с транспирационным током). К числу таких микроорганизмов принадлежат Fusarium и Phytophtora.
Процесс образования пробок в проводящих сосудах под воздействием ферментов можно ослабить или свести на нет с помощью специальных ингибиторов или путем создания условий, снижающих ферментную активность, уменьшив, например, рН до величины 3–4. Такая кислая среда ингибирует действие эндогенных ферментов и сильно снижает активность паразитарной микрофлоры.
Закупорка проводящих сосудов, имеющая физиологическую природу, особенно сильно проявляется у тех цветочных растений, срезка которых богата лигнином. К числу таких растений относится хризантема, одревесневшая базальная часть ее содержит большое количество лигнина, продукты разложения которого оседают на стенках проводящих сосудов. Этому иногда способствуют разлагающиеся в воде вазы остатки стеблей растений. Поэтому необходимо поддерживать чистоту воды.
ГЛАВА 2. ХОЛОДИЛЬНОЕ ХРАНЕНИЕ СРЕЗАННЫХ ЦВЕТОВ И ЧЕРЕНКОВ
Хранение цветочной продукции в условиях пониженных температур наиболее распространено и доступно.
Холод — один из основных компонентов технологии хранения срезанных цветов и черенков, в основу которой положено использование свойств низких положительных температур, а в ряде случаев и близких к 0 °C отрицательных — снижать активность метаболических превращений в хранящейся продукции, а также тормозить развитие микробиологических процессов.
В нашей стране, по данным Г. Д. Горшуновой, для обеспечения сохранности растительной продукции используют свыше 25 % имеющихся холодильных емкостей, из этого количества на долю цветочной продукции приходится около 1 %.

Цветы в сеточной упаковке и уложенные в тару для транспортировки и хранения
Цветочную продукцию в условиях холода хранят обычно сухим или влажным способом. В первом случае цветы помещают в пакеты, коробки и т. д., то есть при хранении отсутствует контакт цветочной продукции с жидкой питательной средой. Во втором случае в качестве жидкой среды, как правило, используют воду, в которой цветы находятся во время хранения.
При всех способах хранения на холоду необходимо учитывать лимитирующий фактор — температуру замерзания цветов, значение которой колеблется от —0,1 °C для тюльпана до —1,7 °C для фиалки; для гвоздики этот показатель составляет около — 1 °C (Игумнов, 1978; Рукавишников, 1985). Кроме того, цветы не рекомендуется хранить с другой растительной продукцией.
На хранение обычно закладывают цветочную продукцию не ниже первого сорта по качеству, без видимых следов химической обработки, механических и микробиологических повреждений.
СРЕЗКА И ПОДГОТОВКА ЦВЕТОВ И ЧЕРЕНКОВ К ХРАНЕНИЮ
Срезка. Срезать цветы и заготавливать черенки нужно в определенный срок и в определенной фазе развития, так как продолжительность хранения и жизни в вазе, а для черенков качество укоренения полностью зависят от степени развития их к моменту срезки и заготовки. Одни цветы срезают в бутонах, которые способны потом в комнатных условиях полностью распуститься в воде, другие — только полностью распустившимися, так как их бутоны в вазе уже не раскрываются.

Цветы в сеточной упаковке и уложенные в тару для транспортировки и хранения
В фазе бутонизации рекомендуется срезать фрезию (от момента окрашивания бутона до раскрытия двух третей цветков), ландыш (при раскрытии до двух третей цветков), нарцисс, тюльпан, некоторые сорта роз (когда концы чашелистиков отделяются от бутона), мак (незадолго до раскрытия), львиный зев.
В полураскрытом состоянии срезают гвоздику ремонтантную, ветвистую и гвоздику Шабо (от момента окрашивания до раскрытия бутона на три четверти), гладиолус (после раскрытия второго цветка), аквилегию, анемону, люпин, ирис (при раскрытии первого бутона), монтбрецию, некоторые сорта сирени.
Наполовину или почти полностью раскрывшимися следует срезать розу (при развернутом первом лепестке), герберу (к моменту созревания пыльцы), лилию красную, дороникум, наперстянку, дельфиниум, рудбекию, бархатцы, незабудки, душистый горошек, сирень, форзицию.
Полностью раскрывшимися срезают цикламен, хризантему, каллы, гортензию, орхидею, астру, флокс, циннию, георгину, васильки, астильбу, ноготки (календулу).
Цветы лучше срезать ранним утром, когда они обладают естественной свежестью и имеют хороший тургор. В холодные дни весны и осени, а также зимой их снимают в поздние часы суток, при большем раскрытии бутонов. Срезать цветы необходимо выше пазухи листа — это обеспечивает лучшие условия для поступления воды в стебель. Срез делают острым режущим инструментом, наискось, чтобы обеспечить большую поверхность поглощения влаги стеблем. Не следует допускать при срезке замятости, скручивания и деформации конца стебля во избежание повреждения его проводящих сосудов.
При срезке цветов на них не должно быть видимых следов капельной влаги от росы или дождя. В противном случае при хранении и транспортировке возможны разогрев и загнивание цветов. Если погода засушливая, то цветы перед срезкой обильно поливают, остаточную Капельную влагу на них в момент срезки стряхивают.
После срезки цветы быстро убирают из мест прямого доступа солнечных лучей и интенсивной освещенности в прохладное затемненное помещение, в простейшем случае — под огороженный навес, где их сортируют и готовят либо к закладке на хранение, либо непосредственно для реализации.
Срезанные цветы сортируют по виду и качеству на товарные сорта по длине цветоноса, внешнему виду, состоянию и типичным признакам для данного сорта. Обычно цветы сортируют на специальных чистых столах или на любой плоской поверхности, предварительно застеленной бумагой, полиэтиленовой пленкой и т. д. После сортировки цветы подсчитывают, формируют в пучки по 10–20 штук, в зависимости от вида и сорта, затем размещают на хранение сухим или влажным способом.
Следует отметить, что процесс сортировки и подготовки цветов к хранению и реализации составляет более 30 % затрат всего рабочего времени.
Быстро увядающие и особо нежные цветы, такие как розы, М. А. Игумнов рекомендует сразу после срезки охладить до 10–15 °C, а затем уже приступать к сортировке и подработке, которая включает удаление части листьев и шипов, а также недоразвитых бутонов.
Подготовка цветов к хранению в простейших холодильных помещениях на льду (в специальных ледниках, погребах и т. п.) заключается в утренней срезке их обычно в период полуроспуска; пионов — за 2–3 дня до раскрытия бутонов, а сложноцветных (георгина, ноготки и др.) — в состоянии роспуска с последующим удалением нижних листьев, боковых побегов и недоразвитых бутонов.
Для влажного способа хранения цветов в воде тюльпаны и нарциссы срезают в фазе закрытых окрашенных бутонов, гвоздику — в свежем роспуске, розы и сирень — в полуроспуске. С нижней части цветоносов следует удалить листья до предполагаемого уровня погружения в воду (обычно на одну треть длины цветоноса).
Для сухого способа хранения срезанных цветов в бумажной упаковке в холодильных камерах рекомендуется срезать тюльпаны и нарциссы в фазе закрытых окрашенных бутонов, а гвоздику — во время свежего роспуска. Для хранения в полимерных пленочных упаковках срезают тюльпаны в фазе закрытых окрашенных бутонов, что исключает их механическое повреждение. Это обеспечивает сохранение декоративности в вазе после снятия с хранения, в то время как тюльпаны, срезанные в полуроспуске, в вазе быстро распускаются и отцветают на 1–2 дня раньше.
Нарцисы срезают в полураскрытом бутоне, так как закрытые бутоны, снятые с хранения и поставленные в воду, в комнатных условиях полностью не раскрываются и теряют свою декоративность.
Гвоздику З. В. Притула рекомендует срезать в фазе окрашенного бутона, фрезию — при полном роспуске первого цветка — в окрашенных бутонах при отогнутых чашелистиках.
Подготовка к хранению влажным способом. Цветы, сформированные в пучки по 10–30 штук в каждом в зависимости от вида и сорта, ставят в воду. Тюльпаны и нарциссы размещают плотно друг к другу во избежание искривления цветоносов. Гвоздики и розы устанавливают в воду более свободно — без сдавливания бутонов, причем каждый бутон розы необходимо обернуть мягкой упаковочной бумагой. В целом емкость с цветами рекомендуется укрывать бумагой либо мягкой неплотной тканью. Воду можно использовать как из водоемов, так и из водопроводной сети. Водопроводную (хлорированную) воду отстаивают в течение суток для удаления избытка хлора, губительно действующего на цветы.
При подготовке цветов к влажному способу хранения следует большое внимание уделять емкостям. Используют сосуды различной глубины (лучше эмалированные или стеклянные), предварительно продезинфицированные, например, путем промывания горячей мыльной водой с раствором нашатырного спирта или ополаскиванием раствором марганцовокислого калия, медного купороса и других дезинфицирующих веществ. В простейшем случае для размещения цветов можно использовать ящики или коробки с широкогорлыми вкладышами из полиэтиленовой пленки.
Цветы в емкостях устанавливают так, чтобы высота сосуда не превышала середину цветоноса, причем уровень воды должен быть не выше половины сосуда.
Подготовка к хранению сухим способом. В зависимости от метода хранения и наличия тары цветы упаковывают в бумагу и размещают на стеллажах или — в бумагу и картонные коробки, в полимерные пленочные упаковки и картонные коробки и т. д.
Для хранения на леднике и в погребах на льду, а также в холодильных камерах цветы укладывают пучками, предварительно обернутыми бумагой, в картонные коробки, выложенные изнутри тонкой полиэтиленовой пленкой либо покрытые импрегнированным и водоотталкивающим составом. Каждый ряд цветов прокладывают слоем мягкой бумаги. Оптимальной укладкой является размещение в каждом слое пучков цветоносами навстречу друг другу, а бутонами к торцам, коробки, причем в нее должен быть обеспечен свободный доступ воздуха. Для хранения сухим способом в холодильных камерах возможна упрощенная упаковка цветов только в бумагу. В этом случае пучки цветов по 20–30 штук заворачивают в бумагу (по ГОСТ 16711—71 или ГОСТ 9840—74) и размещают в 3–4 ряда на стеллажах.
Хорошие результаты хранения получают при упаковке цветов в полимерные пленочные пакеты. Для срезанных цветов применяют пакеты, длина которых должна на 10–12 см превышать длину помещаемых в них пучков цветов (Peist, 1985). Лучшее хранение обеспечивается в упаковках из перфорированного полистирола (700 отверстий на 1 дм
2) толщиной 32 мкм. При отсутствии готовых упаковок их делают путем вырезки необходимых заготовок, например из полиэтиленовой пленки, и склеивания с помощью специальных термосварочных установок или аппаратов, в простейшем случае — утюгом или бытовым паяльником через целлофановую, фторопластовую пленку, в крайнем случае через чертежную кальку.
Пучки цветов закладывают в пакеты без сдавливания бутонами внутрь, с последующей частичной герметизацией упаковки, для чего подворачивают горловину пакета и помещают его либо сразу на стеллаж, либо предварительно в открытые картонные коробки. Для хранения на льду цветы упаковывают в пакеты, мешки из парафинированной или крафт-бумаги, полимерной пленки или любого другого водоотталкивающего материала и перед установкой на лед вертикально размещают в коробки.
При подготовке к хранению в упаковках необходимо предусматривать возможность доступа к цветам воздуха во избежание накопления этилена и излишних количеств углекислого газа, вызывающих ухудшение качества цветочной продукции.
Возможна комбинированная упаковка цветов в бумагу, затем в полимерные пакеты с последующим размещением в открытые картонные коробки, однако при этом возникает опасность стимуляции грибных заболеваний в случае нарушений температуры хранения.
Следует избегать плотной укладки цветов в тару, так как это может привести к повышению влажности и температуры в массе продукции, что создает условия для развития паразитарной микрофлоры.
Опытным путем определена оптимальная упаковка каждого из видов цветов как в отдельном пучке, так и в коробке (табл. 3).

Таблица 3. Упаковка цветов
При подготовке к транспортировке стыки коробок оклеивают бумажной лентой и обвязывают коробки бечевкой или крепким шпагатом. В отдельных случаях практикуют обшивку коробок марлевым материалом, а затем опломбирование или опечатывание.
Технологическая схема упаковки цветов для хранения и транспортировки приведена на рисунке 4.

Рис. 4. Схема упаковки цветочной срезки в тару для хранения и транспортировки: 1 — связка в пучки; 2 — обертывание в бумагу; 3 — закладка в коробку рядами с переслаиванием бумагой; 4 — оклейка стыков бумагой, обвязка
Многообразие типоразмеров коробок и видов используемой для упаковки цветов бумаги усложняет производственные процессы в цветоводческих хозяйствах, а также создает дополнительные проблемы при хранении и транспортировке. Один из возможных путей унификации упаковки для некоторых видов цветов (гвоздики, хризантемы и т. п.) — упаковка их пучков в полимерную рукавную сетку (Рукавишников, 1980). В этом случае срезанные цветы в состоянии полуроспуска или окрашенных бутонов формируют в пучки по 20–30 штук и с помощью специального приспособления проводят упаковку в отрезки полимерной рукавной сетки. Схема упаковки показана на рисунке 5.

Рис. 5. Упаковка цветов с применением полимерных сеточных материалов
Цветы упаковывают следующим образом. Каждый пучок цветов устанавливают в воронкообразное приспособление для упаковки, на горловине и стойке которого находится запас полимерной рукавной сетки. Удерживая букет вертикально (бутоны находятся в воронкообразной горловине устройства), стягивают сетку на стебли на 10–15 см ниже бутонов. Затем, удерживая сетку на стеблях, изымают букет из горловины устройства так, чтобы сетка охватывала бутоны и сходилась венчиком над ними (рис. 6). В этом месте сетку отрезают и букет с закрепленной на цветоносах сеткой готов для укладки в коробку. Остаток сетки стягивают на горловину вниз, освобождая место для следующего букета, подлежащего упаковке. Для упаковки одного букета достаточно 30–35 см рукавной сетки. Рассмотренный метод упаковки более чем в 2 раза экономичнее упаковки цветов в бумагу.

Рис. 6. Схема упаковки цветов для хранения и транспортировки с применением полимерной рукавной сетки: 1 — связка в пучки; 2 — упаковка пучков в сетку; 3 — закладка в коробку; Два варианта упаковки коробки с цветами: 4 — с помощью сетки, бумажной липкой ленты и опломбирования; 5 — с помощью бумажной ленты и шпагата
Срезанные цветы, упакованные пучками в сетку, укладывают в коробки по общепринятой методике.
Для транспортировки коробки можно упаковывать в двух вариантах. В первом варианте после оклейки стыков бумажной ленты коробку с цветами затаривают в широкую полимерную рукавную сетку, концы которой собирают в пучок или сваривают с последующим опломбированием; во втором — коробку с цветами, упакованными в рукавную сетку, оклеивают и обвязывают обычным порядком (см. рис. 5).
Подготовка черенков к хранению. Практика показывает, что обычно от момента заготовки черенков до их высадки на укоренение проходит в зависимости от вида культуры и условий возделывания от нескольких дней до нескольких месяцев. Для гвоздики ремонтантной, например, до высадки на укоренение необходимо сохранить биологические качества стеблевых черенков в течение 2–3 летних месяцев.
Для хранения с материнского растения снимают вызревшие, здоровые, без видимых следов повреждений и капельной влаги черенки. Заготовленные черенки, например розы, тщательно сортируют, формируют в пучки, снабжают каждый из них этикеткой с указанием сорта, количества и даты срезки.
При хранении в ледниках черенки после предварительной подготовки размещают непосредственно на лед. Травянистые черенки (гвоздика) перед отправкой на хранение в леднике размещают в картонные коробки с обозначением количества, вида и сорта.
Хорошие результаты дает упаковка черенков перед закладкой на хранение в полимерные пленочные пакеты. В этом случае в них закладывают свежие заготовленные черенки по 25–30 штук. Пакеты ставят вертикально в картонные коробки, выстланные водоотталкивающим материалом, по 600–800 в каждую коробку. Сформированную таким образом упаковку снабжают этикеткой.
В простейшем случае подготовка к холодильному хранению стеблевых черенков гвоздики заключается в их заготовке и размещении без взаимного сдавливания в вертикальном положении в полимерных ящиках или картонных коробках, выстланных полиэтиленовой пленкой, с последующей установкой в открытом виде на стеллажах хранилища. Сверху черенки прикрывают 1–2 слоями упаковочной бумаги, смоченной в воде.
Для некоторых видов стеблевых черенков цветочных культур, например розы, рекомендуется комбинированная упаковка. Заготовленные черенки длиной 20–25 см с 6–8 почками формируют в пучки и заворачивают в крафт-бумагу. Затем их помещают в полиэтиленовый пакет с открытой горловиной или заворачивают в полиэтиленовую пленку (Khan, 1983).
ХРАНЕНИЕ ЦВЕТОВ И ЧЕРЕНКОВ С ИСПОЛЬЗОВАНИЕМ ЛЬДА
Хранение цветов на льду используют при отсутствии холодильных емкостей. Наиболее удачна конструкция хранилища с ледником системы М. М. Крылова. Такой тип хранилища окупается примерно за год за счет увеличения срока хранения срезанных цветов и черенков, продления срока реализации при сохранении на высоком уровне товарных качеств продукции.
Перед закладкой на длительное хранение цветочную продукцию рекомендуется предварительно выдерживать в прохладном тамбуре или подвале в течение 2–3 ч при температуре 10–15 °C. Срезанные цветы и заготовленные черенки, упакованные в коробки, размещают на ледовой подушке хранилища. При этом во избежание подмокания тары используют различные подкладки.
Оптимальный температурно-влажностный режим срезанных цветов и черенков в хранилище с ледником следующий: температура от 0 до 1 °C, относительная влажность воздуха от 80 до 90 %. Для поддержания необходимого режима хранения ледовую подушку следует периодически посыпать поваренной солью из расчета 1 кг на 1 м
2 площади. Срок хранения черенков в таких условиях составляет до 30–45 дней. После снятия с хранения и обновления среза черенки высаживают на укоренение. Технологическая схема хранения черенков в леднике дана на рисунке 7.

Рис. 7. Схема хранения стеблевых черенков в леднике: 1 — заготовка и сортировка черенков; 2 — закладка на хранение; 3 — обновление среза и высадка на укоренение
Срезанные цветы сохраняются на льду в зависимости от сорта, в течение следующих сроков (в днях).

Рис. 7. Схема хранения стеблевых черенков в леднике: 1 — заготовка и сортировка черенков; 2 — закладка на хранение; 3 — обновление среза и высадка на укоренение
Цветы можно хранить и в ледяной оболочке, которой их покрывают путем распыления воды при температуре ниже 0 °C, но выше точки замерзания цветов. При этом цветы предварительно охлаждают в течение суток до 0 °C. После обработки и образования ледовой «рубашки» цветы засыпают увлажненными опилками и хранят при температуре — 0,5 °C.
Простейший способ хранения — размещение срезанных цветов на льду в погребе. Такое хранение, по данным В. А. Андреичевой, позволяет при 0 °C сохранить срезанные цветы ирисов, лилий и другие с начала июня до конца августа; пионов — до начала октября; роз, ноготков, гладиолусов и васильков в зависимости от сорта — с начала октября до середины декабря.
В помещении, снабженном вентиляцией для кратковременного хранения цветов и черенков, возможно применение сухого льда (твердой углекислоты), который равномерно распределяют между коробками с упакованной продукцией или размещают в углах хранилища. Сухой лед, обладая способностью сублимироваться при температуре — 78,9 °C, обеспечивает охлаждение цветов и черенков, поглощая 640 кДж/кг тепла из объема хранилища, что соответствует двукратной холодопроизводительности обычного льда, получаемого из воды.
ХРАНЕНИЕ ЦВЕТОВ И ЧЕРЕНКОВ В ХОЛОДИЛЬНЫХ КАМЕРАХ СУХИМ И ВЛАЖНЫМ СПОСОБАМИ
Необходимое условие успешной сохранности срезанных цветов и черенков — постепенное охлаждение их до температуры хранения. Для выполнения этого требования рекомендуется цветы и черенки из теплицы или открытого грунта переносить в сортировочно-упаковочное помещение с температурой 15–17 °C, затем после сортировки и упаковки — в переходный тамбур хранилища или холодильной камеры с температурой 1–4 °C и влажностью 80–90 %. Выдерживать цветы в каждом из промежуточных температурных режимов, как указывает 3. В. Притула, следует не менее 2 ч. Хранилище предварительно должно быть освобождено от других видов растительной продукции, проветрено и по возможности продезинфицировано. Необходимо строгое соблюдение режимов хранения. На успех хранения влияет не только средний уровень температурно-влажностного режима среды, но и их суточные колебания. Колебания температуры допускаются в пределах 1–2 °C и относительной влажности воздуха — не более 5 % от оптимальных параметров для данного вида цветочной продукции.

Хранение цветов с применением различных газоселек тивных элементов мембранного типа (ГСЭМТ)
При отсутствии капитальных
хранилищ и холодильных камер для малых и средних хозяйств, где площадь, занятая цветочными культурами, составляет от 1 до 5 га, рекомендуется строительство универсального упрощенного хранилища, пригодного для хранения срезанных цветов и черенков, а также луковиц и корневищ. Оно должно иметь 2–3 камеры, что позволяет в одно и то же время создавать различные режимы хранения в зависимости от закладываемой продукции. При небольшом объеме хранения под хранилище подобного типа можно переоборудовать любое помещение без окон. Камеры в помещении выгораживают с помощью двухслойной полимерной пленки толщиной 150–250 мкм. Толщина воздушной подушки между перегородками должна быть не менее 50 мм. Подобное конструктивное решение позволяет обеспечить хорошую теплоизоляцию стен. Хранилище оснащают приточно-вытяжной вентиляцией с 3—5-кратным обменом воздуха в час.
Камеру для хранения цветочной продукции оборудуют навесными открытыми испарителями и воздухоохладителями. Необходимый режим хранения в малогабаритных камерах можно обеспечить бытовыми кондиционерами. Для увеличения коэффициента использования полезного объема хранилища камеры оборудуют стеллажами. При хранении срезанных цветов сухим способом в бумажной упаковке нарциссы и тюльпаны сохраняют качество до пяти дней, гвоздика — до десяти. Увеличение продолжительности хранения приводит к потере тургора, декоративности и снижению потребительских качеств цветов. В результате длительных исследований и экспериментов, проведенных в Научно-исследовательском институте горного садоводства и цветоводства, установлены сроки и режимы холодильного хранения срезанных цветов, а также продолжительность их жизни в комнатных условиях после реализации (табл. 4).

4. Продолжительность жизни цветов после хранения сухим и влажным способами
По данным ряда исследователей (Кусильман, 1978), при сухом способе хранения срезанных цветов в плоской коробчатой таре для складирования 1000 гвоздик необходимо около 0,6 м
3 холодильного помещения, того же числа хризантем — 2,5–5 в зависимости от сорта, для тюльпанов — 0,8 м
3. Для хранения роз при площади их возделывания 1000 м
2 достаточно 4 м
3 объема холодильной камеры.
Ю. И. Ждамировым и другими специалистами-цветоводами для различных видов цветов разработаны температурные режимы холодильного хранения (табл. 5).

Таблица 5. Температурные режимы хранения срезанных цветов влажным способом
Отечественный опыт хранения срезанных цветов влажным способом показывает наличие определенной зависимости времени жизни цветов в воде при комнатной температуре от сроков их холодильного хранения при температуре 4–6 °C (табл. 6).

Таблица 6. Время жизни срезанных цветов в вазе в зависимости от продолжительности их хранения влажным способом
В таблице 7 приведены значения температуры замерзания различных видов цветов, оптимальные соотношения режимов хранения срезанных цветов на холоду и продолжительности жизни в воде при комнатных условиях.

Таблица 7. Режимы сухого хранения срезанных цветов и время их жизни в вазе после хранения
В общем случае технологическая схема хранения цветов сухим и влажным способом в холодильных камерах представлена на рисунке 8.

Рис. 8. Схема хранения срезанных цветов сухим и влажным способами: 1 — срезка цветов; 2 — предварительное охлаждение; 3 — подрезка стебля под водой; 4 — хранение цветов сухим способом; 5 — хранение цветов влажным способом со сменой воды и подрезкой стебля
При небольшом количестве цветов, закладываемых для хранения сухим и влажным способом, в качестве холодильной камеры можно использовать бытовой холодильник, за исключением морозильной камеры. Контроль температуры следует проводить не менее чем на двух уровнях холодильника: внизу — в зоне овощного ящика и вверху — в зоне поддона под морозильной камерой. Необходимо до минимума ограничить частоту открывания дверцы холодильника. Нарушение этого условия приводит к нестабильности температурного режима, что вызывает появление конденсата на хранимой продукции и развитие порчи в результате микробиологических процессов.
По данным немецких цветоводов, оптимальные температуры и сроки холодильного хранения срезанных цветов следующие:
при 4 °C для астры, каллы, георгины, герберы и ириса — 7—10 дней; ландыша, гвоздики — 7; ноготков, львиного зева, люпина — 3–6; душистого горошка — до 4 дней;
при 1,5 °C для хризантемы, пиона, гладиолуса в
роспуске — до 2 недель; лилии — 1 месяц; пиона в бутонах — 3–4, розы — 1 неделя.
Для кратковременного хранения влажным способом, например сирени, срезанной в период полуроспуска, в этих условиях достаточно ее содержание в холодильнике с температурой 3–5 °C в течение 4–6 ч. Поставленные затем в воду при комнатной температуре цветы сохраняют свою декоративность в течение 12 дней.
Хранить срезанные цветы гвоздики рекомендуется при температуре 1–0,5 °C в течение 4–5 недель в полимерной упаковке (Цветкова, 1971; Amariutei, 1979). Время жизни цветов в вазе после снятия с хранения составляет в этом случае 5–8 дней.
Опытное хранение срезанных цветов гвоздики сортов Вильям Сим и Портрейт, уложенных в шесть слоев в картонные коробки, которые изнутри были покрыты полиэтиленовой пленкой, при температурных режимах 9, б и 1 °C позволило установить оптимальную температуру 1 °C. При этом максимальные сроки хранения лимитируются не физической устойчивостью цветочного материала, а грибными поражениями. После четырех недель хранения наблюдался полный роспуск бутонов, при хранении 35 дней бутоны сохраняли свежесть, гибель из-за болезней составила более 10 %. Исходя из этих результатов рекомендуется ограничить срок хранения гвоздики до трех недель. Стойкость цветов после хранения ниже, чем у помещенных в воду сразу после срезки. После 25 дней хранения они стоят в вазе 2–7 дней, в то время как установленные в воду сразу после срезки — 6–9 дней. Если после хранения провести термическую обработку стеблей цветов водой с температурой около 40 °C, то их жизнь в вазе уменьшается на два дня (Reist, 1985).
Холодильное хранение влажным способом срезанных цветов гвоздики ветвистой. при температуре 2 °C и относительной влажности воздуха 95 % в течение 6—17 дней показало, что сохранность цветов в вазе в комнатных условиях сократилась до 4–6 дней по сравнению с 7 днями в контроле. Подобное хранение не влияло на время возникновения первого пика выделения цветами этилена, что обычно служит сигналом интенсификации процессов старения и отцветания. Однако интенсивность старения лепестков и бутона в целом росла с увеличением времени хранения. Интервал от первого пика выделения этилена до скручивания лепестков составил 3,9 и 1,7 дня соответственно против 4,3 дня в контроле.
За 1–2 дня до увядания срезанных цветов гвоздики в них происходит резкое падение активности фермента инвертазы (Halaba, 1983), что позволяет прогнозировать состояние срезки цветов по динамике изменения этого показателя.
Хранение срезки цветов в условиях холода в ФРГ показало, что жизнеспособность, например, гвоздики после семи дней выдержки в хранилище при 1 °C в комнатных условиях (в вазе) сокращается на 1–2 дня по сравнению со свежесрезанными цветами. Основная причина преждевременного старения и отцветания цветов — поражение среза цветка и его сосудистой системы бактериями или грибами. Кроме того, при помещении цветов в свежую неотстоявшуюся воду наблюдается закупорка сосудов стебля растворенным в воде кислородом и полифенольными соединениями.
При хранении гвоздики влажным способом в условиях температур ниже 6 °C иногда происходит изменение окраски лепестков. В то же время для сухого хранения гвоздики рекомендуется температурный режим 0,5–0 °C.
Для
хризантем открытого грунта, например сорта Брейтнер, хранение при температуре 1 °C в течение 21 дня не приводит к ухудшению качества цветов. При увеличении этого срока наблюдаются признаки грибных заболеваний и загнивания тканей.
Наиболее чувствительны к хранению розы, качество которых заметно снижается уже после девяти дней хранения. При влажном способе хранения качество роз ухудшается через пять дней охлаждения. Установлено, что срезанные розы лучше хранятся в жесткой воде, чем мягкой, соленой и дистиллированной. Для хризантем ДИ львиного зева качество воды не влияет на сохранность врезанных цветов. Тепловая обработка стеблей хризантем водой с температурой 80–90 °C приводит к улучшению декоративности бутонов при потемнении стебля. Лучшие результаты, в особенности для роз, получены, когда срезанные цветы хранят в охлажденной до 1–4 °C воде при такой же температуре окружающего воздуха. Представляют интерес данные по влиянию холодного хранения срезанных цветов роз на последующую сохранность их в вазе при комнатных условиях (Faragher, 1984). Цветы хранили сухим и влажным способами в течение десяти дней при температуре 2–1 °C и относительной влажности воздуха 95 %. После такого хранения сухим способом цветы, помещенные в вазу с водой, при температуре 22 °C в условиях относительной влажности воздуха 65 % теряли свою устройчивость на два дня раньше, чем свежесрезанные; после влажного способа хранения устойчивость уменьшалась на три дня. Содержание влаги в лепестках после сухого хранения уменьшалось до 3,89 г (в пересчете на 1 г сухой массы) по сравнению с 4,18 у свежесрезанных цветов, а после влажного хранения оно увеличивалось до 5 г.
Наиболее общее требование при хранении цветов заключается в необходимости уделять особое внимание поддержанию постоянной температуры без резких ее колебаний. Изменение температуры хранения по отношению к оптимальной на несколько градусов приводит к усилению дыхания, транспирации и развитию микробиологической порчи цветочной продукции.
Заметно ухудшаются результаты хранения при повышении температуры из-за увеличения интенсивности дыхания и выделения этилена — газа, способствующего старению и отцветанию бутонов. Простейшие пути снижения концентрации этилена — периодическая вентиляция хранилища или использование препаратов, связывающих и нейтрализующих этилен, например активированного угля, в том числе пропитанного бромом, а также специальных химических препаратов.
Стеблевые черенки, например гвоздики, можно хранить сухим способом в полимерных пакетах, размещенных в картонных коробках. Технологическая схема такого хранения, разработанная И. Л. Зленко, приведена на рисунке 9.
Вначале коробки с черенками в приоткрытом виде устанавливают на стеллажи в помещении с температурой 6–8 °C, где они проходят адаптацию в течение 1,5–2 суток. Затем их размещают на постоянное хранение в холодильную камеру с температурой 2–4 °C и относительной влажностью воздуха 70–80 %. Ступенчатый переход к оптимальному режиму хранения можно осуществить в одной и той же камере путем постепенного понижения температуры до 2–4 °C в течение 2–3 суток. Через 5–6 суток холодного хранения, когда упадет интенсивность дыхания, всю партию черенков в коробках укрывают дополнительно полиэтиленовой пленкой.

Рис. 9. Схема холодильного хранения черенков в открытых полиэтиленовых пакетах: 1 — заготовка и сортировка черенков; 2 — упаковка в полиэтиленовые пакеты, коробки и предварительное хранение; 3 — хранение на стеллажах в пакетах и коробках; 4 — обновление среза и высадка на укоренение
В процессе хранения недопустимо даже кратковременное повышение температуры на несколько градусов, ибо при этом образуется обильный конденсат, что влечет за собой вспышку грибных заболеваний, спонтанное размножение микрофлоры и массовую гибель черенков. Хранение в этих условиях сопровождается характерным побурением основания черенков.
Максимальный срок хранения хорошо вызревших черенков массой 3–4 г зимой и 6–9 г весной и летом при температуре от 0,5 до 3 °C доходит до трех месяцев. При более длительном хранении даже при соблюдении всех профилактических мероприятий для данного способа сухого хранения брак от грибных заболеваний достигает 60 %, причем оставшиеся черенки плохо укореняются и около 70 % их гибнет.
Наиболее простой способ сухого хранения стеблевых черенков гвоздики — размещение их в полимерные ящики при температуре 2–4 °C с последующим укрытием периодически смачиваемой бумагой — позволяет сохранить тургор и потребительские качества черенков в течение 1,5–2 месяцев.
При содержании стеблевых черенков роз в холодильных камерах с температурным режимом в диапазоне от 0 до 4 °C и относительной влажностью воздуха 80–90 % максимальная продолжительность хранения до одного года была достигнута при температуре около 0,6 °C (Khan, 1983).
Упрощенный метод хранения стеблевых черенков предусматривает их прикопку в землю и содержание при температуре около 0 °C с осени до марта и последующую высадку в грунт.
При хранении
корневых черенков роз сухим способом в холоде отмечено губительное влияние на корневые зачатки выделяемого растениями этилена (Meadows, 1983).
При температуре хранения черенков роз 5 °C этилен в концентрации 280 миллионных долей снижает способность побегообразования и развития корней на 80 %. Воздействие на корневые черенки роз, упакованные пучками в крафт-бумагу и полиэтиленовые пакеты, этиленом в концентрации 0,1, 10, 100 и 1000 млн
-1 при хранении до четырех недель в холоде от 0 до 5 °C вызывает отмирание побегов и проросших почек после высадки в субстрат. Причем понижение температуры хранения до 0 °C приводит к отмиранию от 15 до 50 % побеговв зависимости от концентрации этилена. Повышение температуры до 5 °C давало увеличение процента отмирания от 20 до 85 %. В связи с этим хранение черенков рекомендуется проводить изолированно от этиленобразующих растительных объектов (цветов, плодов, овощей и т. д.).
ПОДГОТОВКА ЦВЕТОВ К РЕАЛИЗАЦИИ И ЧЕРЕНКОВ К УКОРЕНЕНИЮ
При подготовке снятых с хранения в леднике срезанных цветов к реализации, а черенков к укоренению рекомендуется выдержать их в течение 2–3 ч в тамбуре или промежуточной камере при температуре 10–15 °C для равномерной их дефростации (размораживание) и постепенной активизации метаболических процессов.
В ночное время или в затемненном прохладном помещении в дневное время у цветов и черенков обновляют срез под водой и ставят цветы в охлажденную воду, погружая до самых бутонов. Черенки ставят в раствор ростактивирующих веществ. Емкость с цветочной продукцией накрывают мягкой бумагой либо тканью. Обычно тургор у цветов и черенков восстанавливается полностью за 8—10 ч, после чего их сортируют. Затем цветы упаковывают и отправляют в реализацию, а черенки высаживают в субстрат на укоренение.

Хранение цветов с применением различных газоселек тивных элементов мембранного типа (ГСЭМТ)
Устойчивость цветов после снятия с хранения в леднике и установки в воду в комнатных условиях сохраняется в течение 4–7 дней в зависимости от вида и сорта.
Подготовку цветов к реализации после хранения в холодильных камерах необходимо проводить в подсобном помещении хранилища при температуре не выше 15 °C. В противном случае резкое повышение температуры может привести к ухудшению качества продукции.
За время хранения и транспортировки при сухом способе цветочная продукция теряет значительное количество влаги. В этой связи важной проблемой является «оживление» срезанных цветов с целью восстановления и сохранения декоративности после их реализации.
Продолжительность содержания срезанных цветов в упакованном виде после их хранения в холоде не должна быть более одних суток, иначе цветы теряют устойчивость и декоративность в воде при комнатных условиях. Поэтому после хранения и транспортировки цветы рекомендуется быстро распаковать, не извлекая из упаковки, а только вскрыв ее, и подержать при свободном доступе воздуха 2–3 ч, затем, вынув из упаковки, поместить в прохладную воду в темном, но хорошо проветриваемом помещении. Перед реализацией делают повторный срез стеблей цветов под водой при температуре воды в емкости 8 °C летом и 12–18 °C зимой. Температура окружающего воздуха для цветов, подготавливаемых к реализации, должна быть в пределах 4–6 °C.
В случае задержки с реализацией для сохранности цветов в подсобных помещениях необходимо ежедневно менять воду в емкости с тщательной промывкой последней раствором дезинфицирующих веществ. Концы стеблей при этом также тщательно промывают, удаляют нижние и утратившие товарный вид листья.
Более сложный, но эффективный метод подготовки цветов к реализации после холодильного хранения сухим способом заключается в следующем. После обновления среза под водой цветы ставят в теплую воду с температурой 30–40 °C, погружая не менее чем на три четверти цветоносов. При этом температура окружающего воздуха в помещении должна быть около 4–6 °C, и только после того как тургор цветов полностью восстановится, их переносят в прохладное помещение для сортировки.
Возможно также постепенное ступенчатое выравнивание температуры снятых с хранения цветов в течение 15–20 ч до комнатной температуры с последующим размещением их после обновления среза в емкости с водой.
Хорошие результаты (после четырех недель сухого хранения) дают обновление среза и погружение снятых с хранения цветов в теплой водный раствор консерванта на одну треть длины цветоноса. Длительность такой обработки при температуре в помещении около 4 °C составляет 18–20 ч. После постановки в вазу в комнатных условиях бутоны полностью распускаются, а устойчивость цветов в букете составляет 5–7 дней.
Пучки цветов, хранившихся влажным способом, перед упаковкой в бумагу и коробки, осторожно встряхивают для удаления капельной влаги, а сверху промокают фильтровальной бумагой. Хранение тюльпанов в воде ослабляет устойчивость цветоносов, что затрудняет упаковку и перевозку этих цветов, в связи с чем рекомендуется их реализация без транспортировки.
При снятии черенков роз с хранения зимой прикопкой продолжительностью до 5–6 месяцев и последующей высадке в тепличные условия их рекомендуется выдерживать 2–3 недели при температуре 25–30 °C, а затем укоренять в субстрате. Обычно укоренение при температуре 15 °C и относительной влажности воздуха около 70 % происходит в течение двух недель.
В случае сухого хранения стеблевых черенков гвоздики в полимерных упаковках для снятия с хранения следует ступенчато повышать температуру. По окончании срока хранения черенки выдерживают до двух дней в условиях промежуточной температуры 10 °C. В этих же условиях их замачивают в воде в течение 1 ч, а затем переносят в комнатные условия с температурой 18–20 °C и выдерживают 1–2 ч, после чего проводят обработку раствором ростактивирующих веществ в течение 2—12 ч.
Следует отметить, что после хранения черенков перед их высадкой на укоренение необходимо обновлять срез. Несоблюдение данного условия ведет к значительному I. выпаду черенков при укоренении.
Благоприятное действие на черенки оказывает предпосадочное охлаждение до 5 °C в течение 7—10 дней. В этом случае укоренение проходит интенсивнее на 5–7 дней и процент выхода укорененных черенков заметно повышается.
Таким образом, чтобы повысить выход цветочной срезки, необходим комплексный учет всех факторов подготовки к хранению, самого процесса хранения в холоде и подготовки цветочной продукции к реализации.
ГЛАВА 3. УСОВЕРШЕНСТВОВАННЫЕ МЕТОДЫ ХРАНЕНИЯ СРЕЗАННЫХ ЦВЕТОВ И ЧЕРЕНКОВ
Как уже отмечалось в главе 1, к факторам, сокращающим сроки жизни срезанных цветов и черенков, (относятся: влагопотери, закупорка сосудов стебля бактериями и микроорганизмами, блокировка сосудов ксилемных тканей продуктами деятельности ферментов, нарушения клеточных механизмов, регулирующих дыхательные процессы. Воздействие холодом позволяет до некоторой степени уменьшить пагубное влияние перечисленных факторов, однако оно не всегда отвечает возросшим требованиям промышленного цветоводства. В этой связи в последние годы ведется интенсивный поиск усовершенствованных методов хранения цветочной продукции на основе сочетания холода с применением различных химических веществ и других средств.

Использование разных видов ГСЭМТ для хранения цветов
Постановка срезанных цветов в обычную воду даже в холоде не приводит к значительному продлению срока их жизни из-за отрицательных биохимических свойств воды. Так, вода лишена практически всех минеральных компонентов, гормонов, метаболитов, характерных для физиологических функций клеточного сока.
Чистая вода может способствовать прохождению реакций окисления и перехода нетоксичных метаболитов в побочные токсичные продукты. Органическое и минеральное загрязнение воды отрицательно воздействует на клетки срезанных цветов и черенков. Токсическое действие оказывают и минеральные яды: фтористые соединения, олово, соли мышьяковой кислоты. Клеточный сок, попадая в воду, претерпевает изменения и вследствие окисления полифенолов становится токсичным для срезанных цветов и черенков.
Существенную роль в регуляции процессов старения и увядания цветочной продукции играет этилен, сопутствующий дыхательным процессам. Степень его воздействия на продукцию наряду с регуляцией ее дыхания можно ограничить путем применения различного рода препаратов и химических веществ.
ХРАНЕНИЕ ЦВЕТОВ С ПОМОЩЬЮ ХИМИЧЕСКИХ СРЕДСТВ
В результате многочисленных исследований и экспериментов, проведенных как в нашей стране, так и за рубежом, установлено, что химические препараты позволяют в значительной степени снизить губительное влияние на цветочную продукцию стрессовых явлений и сохранить ее качество в процессе содержания в холоде, в комнатных условиях, а также при транспортировке. По своим свойствам (бактерицидным, фунгицидным, ингибирующим, наркотическим, питательным и др.) химические препараты можно разделить на четыре группы: уменьшающие рН раствора, создающие кислую среду и препятствующие размножению бактерий; тормозящие рост микроорганизмов или уничтожающие их; ослабляющие блокировку сосудов; питающие растения.

Использование разных видов ГСЭМТ для хранения цветов
В настоящее время в практике цветоводства для сохранения декоративности и товарных качеств продукции, продления ее жизни в холоде и в комнатных условиях применяется большой спектр химических веществ и препаратов. Следует отметить, что для сохранения качества срезанных цветов с помощью химических препаратов необходимо перед постановкой их в раствор препарата обновлять срез под водой.
Важную роль в сохранении качества цветочной продукции при хранении играют физиологически активные вещества и препараты на их основе. Оказывая влияние на обмен веществ, ростовые и гормональные процессы, темпы развития и старения, они служат инструментом управления жизнедеятельностью растительного организма на всех фазах его развития. Этот класс химических соединений все шире применяется в практике хранения.
Известен большой набор физиологически активных веществ для продления жизни срезанных цветов и черенков как в комнатных условиях, так и при холодильном хранении, а также специальные препараты, выпускаемые для этих целей в нашей стране и за рубежом. По данным М. А. Игумнова, к таким препаратам относятся Бутон, Бутон-2, Нора, Витант-1 и его модификации, Хризал, Этиссо, Сабстрел, Кэмпо, Эверблум, Корнелл, Цветин и др. В общем случае технологическая схема хранения срезанных цветов с применением химических препаратов показана на рисунке 10.

Рис. 10. Схема хранения срезанных цветов с применением химических препаратов: 1 — срезка цветов; 2 — подрезка стебля под водой; 3 — выдерживание в емкости с водой и раствором химических препаратов; 4 — хранение цветов сухим способом; 5 — хранение влажным способом
Из физиологически активных препаратов наиболее известны и широко применимы гидразид малеиновой кислоты (ГМК) и его соли, N
', N
' — диметилгидразид янтарной кислоты (алар), 8-оксихинолинцитрат (ХЦ), соли серебра и некоторые другие. Из отечественных особенно эффективны препараты группы Витант (Грод-зинский, 1984). Срезанные цветы гвоздики ремонтантной сохраняют свое качество в препарате Витант-1 в комнатных условиях в течение 22–25 дней по сравнению с 8—10 днями в воде. Витант-1 обеспечивает регулировку обменных процессов не только распустившихся цветков гвоздики, но и таких, которые находятся в фазе тугих бутонов. В воде эти бутоны никогда не расцветают, они засыхают, а в растворе препарата Витант дают полноценные бутоны и распускаются. Применение препарата позволяет таким образом увеличить коэффициент использования полезных площадей, занятых цветочными культурами, сократить потери и гибель цветов при срезке, сортировке и транспортировке.
Для сирени рекомендуется препарат Витант-2, который позволяет иметь распустившиеся цветы даже в зимнее время. Сохранение качества других видов срезанных цветов также обеспечивает применение соответствующих препаратов группы Витант.
Хорошие результаты получены при использовании препаратов типа Нора отечественного производства, основные компоненты которых: N
', N
'-диметилгидразид янтарной кислоты, сульфат 8-оксихинолина, сахароза и вода дистиллированная. Жидкость Нора позволяет сохранить качество и высокую декоративность срезанных цветов в комнатных условиях и в холодильных камерах в 1,5–2 раза дольше, чем при хранении в водопроводной воде.
Находит применение физиологически активный препарат типа Бутон на основе водного раствора гидразида малеиновой кислоты, борной кислоты, квасцов алюмо-калиевых и сахарозы (Петоян, 1974). Сохранность гвоздики при использовании этого препарата составляет 20–25 дней, розы—10–15 дней при температуре 1–3 °C, а в комнатных условиях соответственно 10–12 и 6–8 дней.
К многокомпонентным физиологически активным веществам для продления жизни срезанных цветов, по данным А. М. Гродзинского, относится состав, содержащий водорастворимое неионное питательное вещество, источники ионов калия, фосфора, бора, магния, кальция, марганца, сульфат и ингибиторы ферментации и развития микрофлоры.
Питательный раствор 8-гидроксихинолинсульфата с сахарозой позволяет сохранить установленные в него срезанные хризантемы при комнатных условиях на 3–4 дня дольше, чем в обычной воде. При этом рекомендуется удалять нижние листья, а цветоносы погружать в раствор не более чем на 8—10 см.
Система применения физиологически активных веществ «Севафлор», разработанная за рубежом, предусматривает сохранение качества срезанных цветов в холоде и в комнатных условиях путем комплексной их обработки в срезанном виде в фазе окрашенного бутона препаратами комбинированного действия, стимулирующими развитие бутонов, антисептирующими воду и консервирующими цветоносы (Paulin, 1983).
Польские специалисты используют для сохранения срезанных цветов препараты профловит-71, профловит-80 и профловит-81 (Rudnicki, 1982), которые наиболее эффективны при холодильном хранении срезанных гвоздик (при температуре 0–1 °C и относительной влажности воздуха 85–95 %). Срок хранения тугих бутонов гвоздики достигает 16–20 недель, а продолжительность жизни в вазе в комнатных условиях — до десяти дней при условии обработки воды препаратами серебра и фунгицидами типа роврал и сумилекс.
К химическим препаратам сложной структуры для хранения срезанных цветов относится биологически активное вещество бромистый диметил-р-бромэтилсульфоний (БЭС), применяемый в виде водного раствора. К. С. Бокарев указывает, что свежесрезанные цветы необходимо выдерживать в течение суток в водном растворе препарата БЭС при концентрации от 100 до 300 мг/л в зависимости от вида цветов. Стебли с удаленными нижними листьями погружают на 3–4 см в раствор. Затем цветы хранят поставленными в водопроводную воду в холоде либо в комнатных условиях. Применение обработки препаратом БЭС дает увеличение сроков хранения цветов в комнатных условиях до 14 дней против 11 в контроле для гвоздики ремонтантной и до 28 дней против 15 в контроле для астры китайской.
Хранение гвоздики с использованием комбинированных растворов консервантов и питательных веществ показало, что их применение определенным образом влияет на выделение цветами углекислого газа и этилена и в целом на процессе увядания (Eisenberg, 1985). В этом случае срезанные в фазе бутона цветы гвоздики хранили сухим способом до 6 ч в холоде при температуре 1–4 °C, затем после обновления среза под водой одну часть их ставили в деионизированную воду (ДИ), а другую — в физиологически активный раствор состава: лимонная кислота — 3,3 мМ, каптан — 0,5 мМ и глюкоза — 0,2 М на 1000 мл воды (М и мМ — молярная и миллимолярная концентрация растворов). Хранение проводили в комнатных условиях. Наблюдения показали, что характер изменений в сырой массе цветов и в том и в другом случае практически одинаков, однако во втором случае он резче выражен. Физиологический раствор обеспечивает увеличение сроков хранения в 1,5–2 раза. Отмечены постепенное повышение выделения углекислого газа по мере старения цветов и резкое его падение при обесцвечивании более чем половины лепестков. Резкий пик выделения этилена наблюдается непосредственно перед обесцвечиванием лепестков или сразу после него.
В последние годы разработан и находит применение за рубежом метод хранения срезанных цветов гвоздики и луковичных культур с применением препаратов фторсин и AKN с добавкой сахарозы и без нее (Pospisilova, 1985). Фторсин представляет собой желто-белое кристаллическое вещество. Оптимальная концентрация его в водном растворе для хранения основных видов цветочной срезки в комнатных условиях составляет 12,5 г/л. Для луковичных цветов она равна 6,25 г/л. Установлено, что лучшие результаты для цветов гвоздики получают при срезке ее в начале окрашивания бутонов с последующим помещением в раствор фторсина или AKN (3 %-ный) без добавления сахарозы. Цветы с предварительно удаленными 2–3 нижними листьями погружают стеблями в раствор на 10–15 см и хранят при температуре 0,5–2 °C и относительной влажности воздуха 90 %. Максимальный срок хранения составляет для гвоздик 2,5–3, для хризантем — 1,5–2 месяца. Цветы, снятые с хранения, для стимуляции роспуска бутонов рекомендуется содержать при комнатной температуре 18–22 °C и освещенности 1000 лк в одном из указанных растворов с добавлением 4–8 % сахарозы. В этом случае бутоны полностью распускаются через 4—10 дней и сохраняют устойчивость еще 10–12 дней.
Устойчивость и качество срезанных цветов гладиолусов при хранении сухим и влажным способами сильно зависят от таких веществ, как сахароза и полиэтилен-гликоль— ПЭГ (Rao, 1982). Цветы, срезанные в закрытых бутонах (за день до появления окраски у нижнего цветка), размещают на сутки на временное хранение сухим способом в комнатных условиях. Это стимулирует активность последующего поглощения питательного раствора, в который помещают цветы на двое суток. Концентрация раствора сахарозы должна быть от 0,25 до 0,5 М. После выдержки в питательном растворе цветы при необходимости помещают в воду, оставляют в растворе сахарозы или ставят в раствор полиэтиленгликоля. Последующее хранение проводят в комнатных условиях.
В период импульсной (прерывистой) обработки (первые 48 ч) наблюдается активное поглощение сахарозы при ее концентрации в растворе около 0,25 М и менее активное при более высокой концентрации (около 0,5 М). ПЭГ в растворе тормозит поглощение сахарозы и соответственно раскрытие бутонов. Основным фактором, лимитирующим раскрытие цветков гладиолуса, является наличие и доступность сахарозы как основного питательного элемента физиологического раствора.
Аналогичные эксперименты со смесью растворов сахарозы и гиббереллина показали, что оптимальной была смесь 0,1 М сахарозы с 110
-4 М гиббереллина. В этом случае цветы (пять бутонов одновременно) распускались на восьмой день и были устойчивы в вазе 11–12 дней.
Сохранности в комнатных условиях срезанных цветов орхидей до трех недель способствует химический препарат субстраль (Klougart, 1984).
При влажном способе хранения срезанных цветов мимозы с применением растворов физиологически активных веществ JNRA, CNPS и хризала установлено, что максимальной эффективностью обладает раствор типа JNRA. В этом случае брали ветви мимозы с нераскрывшимися цветками и после удаления лишних листьев и подрезания стеблей под водой помещали на хранение при температуре 23 °C и относительной влажности воздуха около 100 %. Цветы ставили в воду (контроль), а также в растворы JNRA, CNRS и хризала. После роспуска цветков мимозу хранили в холоде от 0 до 5 °C с упаковкой в перфорированный полиэтилен и картонные коробки. После пяти дней хранения поставленные в воду в комнатных условиях цветы с контрольного варианта не увядали 1,7 дня, после растворов JNRA — 6,2; CNRS — 2,3; хризала — 6,4 дня. После 25 дней хранения эти значения изменились следующим образом: 1,1; 9,2; 1,4 и 5,7 дня соответственно.
Срезанные в состоянии роспуска цветы гвоздики хорошо сохраняются при хранении сухим способом до 20 дней при температуре — 3 °C (Wilkins, 1983). В этом случае цветоносы гвоздики в комнатных условиях обрабатывают в течение 24 ч комплексным раствором диметилсульфоксида в концентрации 6 % с добавлением сахарозы (21 %). Предварительно рекомендуется также кратковременная (до 15 мин) обработка азотнокислым серебром (1000 мг/л). После воздействия этих препаратов цветы упаковывают в полиэтиленовые пакеты с прикрытой горловиной и размещают на холодильное хранение. Следует отметить, что после хранения цветов в течение 20 суток в холоде их устойчивость в вазе не превышает суток, в то время как при хранении в течение 15 суток цветы сохраняют устойчивость в вазе до 7,5 суток.
Эффективным средством, увеличивающим срок жизни срезанных цветов в комнатных условиях в вазе после холодильного хранения, служит обработка их веществами-аналогами цитокининов — 6-бензиламинопурином (БАП) и фурфуриламинопурином. Применение этих препаратов (60 мг на 1 л воды) приводит к увеличению срока жизни цветов в вазе при сохранении декоративности. Обработка кинетином, по данным М. А. Игумнова, улучшает водный баланс и замедляет процессы старения наиболее нежных цветов, таких как розы.
Разработан также следующий способ сохранения срезанных цветов свежими. После срезки цветы ставят в воду в комнатных условиях с добавлением до рН 3,5–2 сильной минеральной кислоты в концентрации 0,2–4 масс. % (чаще 0,5–2 масс. %) по отношению к воде, сорбиновой кислоты — 0,001—0,5 масс. % (чаще 0,001 — 0,01 масс. %), хлорида алкилдиметилбензиламмония (Eucken, 1980). Для некоторых видов цветов к этому составу добавляют 0,005—0,1 масс. % (чаще 0,01—0,05 масс. %) янтарной или глиоксиловой кислоты. Подобный состав увеличивает сохранность цветов в вазе в 1,5–2 раза.
Как указывает 3. В. Притула, простой и общедоступный путь сохранения качества срезанных цветов — применение хвойного экстракта. Хранение срезанных цветов гвоздики в комнатных условиях с применением хвойного экстракта, по данным Научно-исследовательского института горного садоводства и цветоводства, позволяет сохранять качество цветов до 23 дней при срезке в октябре, в то время как в обычной воде они живут лишь 12 дней. При этом продолжительность хранения зависит от времени срезки. Так, при срезке в следующие сроки: 12.01; 17.03; 17.04; 18.05; 20.06; 05.07; 05.08 хранение с добавлением хвойного экстракта составляло соответственно 16; 15; 17; 18; 15; 11; 13 дней; в обычной воде — 9; 7; 9; 10; 4; 6; 6 дней.
Для хранения цветов готовят водный раствор хвойного экстракта — 10 г на 1 л воды с добавкой 50 г сахара. Стебли погружают в раствор на 10–12 см. Нижние листья удаляют, срез стебля перед размещением в сосуде с раствором обновляют под водой. Хвойный экстракт оказывает благотворное действие на декор срезанных цветов. Цветы раскрываются полностью, отличаются яркостью и свежестью окраски, имеют стойкий, характерный для вида запах. Хвойный экстракт обладает пролонгированным бактерицидным действием, предотвращает биологическое замутнение водного раствора, в котором находятся цветы, препятствует появлению плесени и загниванию цветочных стеблей.
ХРАНЕНИЕ ЦВЕТОВ С ПРИМЕНЕНИЕМ МНОГОКОМПОНЕНТНЫХ ФИЗИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ НА ОСНОВЕ СОЛЕЙ СЕРЕБРА
Наибольший эффект при хранении цветов как в холоде сухим и влажным способами, так и в комнатных условиях дает применение солей серебра. Препараты на их основе не только угнетают микрофлору, но и тормозят этиленподобные выделения, ответственные за старение растительных тканей стебля и бутона цветка. Особенно хорошие результаты получают при использовании солей серебра для сохранения срезанных цветов гвоздики.

Общий вид ГСЭМТ
Установлено (Reid, 1980), что при погружении стеблей цветов на 3 см в раствор комплексного соединения тиосульфата серебра (ТСС), содержащего AgNO
3 и Na
2S
2O
3 в молярном соотношении 1/4, с экспозицией от 1 до 60 мин и последующей установкой их в вазу с водой, максимально достижимый срок сохранности качества увеличивается вдвое по сравнению с необработанными цветами. Высокое содержание серебра в стебле — более 5 мкм — вызывает токсический эффект. Оптимальное время выдерживания цветов в растворе, содержащем не более 1 мМ серебра, — 10 мин.
Положительные результаты дает применение чистого тиосульфата серебра. При этом происходит физиологическое торможение солями серебра процесса образования растениями этилена. Так, срезанные гвоздики в течение суток выдерживали в холоде при температуре 0–1 °C, затем помещали на 5 см длины стебля в раствор тиосульфата серебра, а в контроле — в дистиллированную воду. На пятые сутки в комнатных условиях гвоздика в контроле увядала, в то время как в опыте она была нечувствительна к выделенному из раствора (50 мг/л) этилену. Этот эффект достаточно хорошо проявлялся даже при обработке гвоздики тиосульфатом серебра только в течение 4 ч. Лучше сохраняются цветы в растворе тиосульфата серебра при концентрации 0,2 мМ, а при концентрации 2 мМ на листьях появляются темные пятна.
Представляет интерес комбинированный вариант хранения сухим и влажным способом срезанных гвоздик в роспуске до двух недель и в бутонах до 6—10 недель с применением тиосульфата серебра и питательного раствора (Reid, 1983). Лучше всего сохраняются цветы в состоянии полуроспуска и так называемой звезды, однако в последнем случае после хранения при установке цветов в питательный раствор с добавлением консерванта бутоны распускаются через 6–8 дней. В первом случае полный роспуск бутонов наступает уже через 3–4 дня, при этом цветы имеют хорошую декоративность. Технология хранения предусматривает обработку концов стеблей 0,1 %-ным раствором тиосульфата серебра путем погружения на 15–20 см при экспозиции до 2 ч в прохладном помещении (до 15 °C). Затем после удаления капельной влаги раствора срезку упаковывают в картонные коробки с водоотталкивающим слоем или выстланные пленкой, охлаждают до 0 °C и хранят при относительной влажности воздуха 95 %. После снятия с хранения стебли подрезают под водой и цветы ставят в раствор консерванта. Цветы с нераскрывшимися бутонами после подрезки помещают в раствор следующего состава: 200 млн
-1 физана 20 и 10 % сахарозы. Подобная «импульсная» обработка цветов солями серебра тормозит выделение этилена, в результате старение цветов замедляется в 2–3 раза.
Комплексный метод обработки срезанных цветов гвоздики с применением солей серебра с добавками, позволяющий сохранить их качество до 24 недель, разработан и рекомендуется польскими учеными (Goszczynska, 1983). Срезку цветов проводят в фазе плотного, окрашенного бутона с последующим охлаждением до 0–1 °C, подрезкой стебля под водой и удалением не менее двух нижних листьев. Затем цветы погружают в раствор азотнокислого серебра концентрацией 1000 мг/л с 10 % сахарозы или в комбинированный раствор азотнокислого серебра (50 мг/л), Na
2S
2O
3-5H
20 (500 мг/л) и сахарозы (10 %). Цветы, погруженные стеблями на глубину 10–15 см, выдерживают в указанных растворах до 20 ч при температуре около 1 °C.
После обработки растворами цветы подсушивают, заворачивают в мягкую бумагу, закладывают в полиэтиленовые пакеты с открытой горловиной или плотно укрывают полиэтиленовой пленкой. Хранение проводят при температуре 0–1 °C. После снятия с хранения и подрезки стебля под водой цветы размещают в комнатных условиях в вазах с комплексным раствором состава: 8-оксинолинцитрат (ХЦ) (200 мг/л), азотнокислое серебро (25 мг/л) и сахароза (7 %) при температуре 20–24 °C, относительной влажности воздуха 90—100 %, световом периоде 16 ч в сутки и освещенности 200 лк. Полностью раскрывшиеся цветы ставят в вазу с водой комнатной температуры (18 °C).
Обработка цветоносов перед хранением раствором азотнокислого серебра и сахарозы способствует сохранности цветов в вазе до 10–11 дней, в то время как без обработки они живут в вазе 7–8 дней. Комплексная обработка AgNO
3 и Na
2S
2O
35H
20 без сахарозы дает сохранность цветов 11–12 дней, а при добавлении сахарозы — 12–13 дней. Эти цветы, поставленные в вазу с водой сразу после срезки, сохраняют свои декоративные качества до 12 дней.
Лучшие результаты по сохранности качества срезанных цветов получены при обработке цветов в комплексе с азотнокислым серебром и сахарозой ровралем и сумилексом. При хранении в течение 24 недель максимальные потери массы составили 8,3 %. Однако при таком длительном хранении срок жизни цветов в вазе резко падал с 12,5 до 6,5 дня в зависимости от сорта.
Азотнокислое серебро в водном растворе — эффективное средство для сохранения качества цветов герберы. При срезке герберы в период созревания первого круга тычинок в соцветии и установке цветов в раствор азотнокислого серебра концентрацией 30 мг/л в комнатных условиях
устойчивость и декоративные качества сохраняются до 14–15 дней против 7–8 дней в воде (Steinitz, 1982). При добавлении сахарозы (до 6 %) к концу срока хранения наблюдается увядание лепестков цветка при хорошем сохранении упругости стебля. При отсутствии сахарозы стебель к концу хранения искривляется. Хорошие результаты получены для цветов астр при использовании 5 %-кого раствора сахарозы с добавлением 25 млн
-1 нитрата серебра и 75 млн
-1 лимонной кислоты в дистиллированной воде: цветы, помещенные в вазу с добавлением этого состава, сохраняют свои декоративные качества в комнатных условиях до 15 дней. Сохранности цветов способствует также 2 %-ный раствор сахарозы с теми же добавками при 10-минутной выдержке в растворе нитрата серебра в концентрации 1000 млн
-1 перед помещением в воду. Продолжительность хранения 13,7 дня.
Изучение влияния перевозки в рефрижераторах на устойчивость цветов в вазе показало, что при температурах транспортировки 1,7 и 7,7 °C в течение четырех дней в первом случае цветы сохраняются лучше после 10-минутной обработки стеблей в растворе нитрата серебра (9,4—11,1 дня), во втором — в растворе сахарозы в добавлением лимонной кислоты и нитрата серебра (7,7—10,8 дня). Срок хранения цветов в воде без добавок составляет 3,2–5,1 дня, а с добавлением только сахарозы — 2,9–3,7 дня.
Имеется положительный опыт использования для хранения срезанных цветов буры, спирта, глицерина, медного купороса, перманганата калия, квасцов, уксусной кислоты и др.
Так, хорошие результаты получены при использовании этанола в качестве препарата против старения срезанных цветов гвоздики. При помещении цветов в раствор этанола (концентрация до 25,6 % по объему), заменяемый каждые два дня, они сохраняли свою декоративность до 16,6 дня по сравнению с пятью днями в воде. Оптимальная концентрация этанола при этом составляет 8 % (Heins, 1980). Выделение этилена у цветов, находящихся в растворе этанола, было равномерным и замедленным в течение всего периода хранения, в то время как у цветов в дистиллированной воде увеличивалось с третьего по девятый день и достигало максимума на пятый день. Тот же эффект наблюдался при помещении цветов в раствор этанола не сразу после срезки, а после выдерживания в воде. При уменьшении концентрации этанола до 2 % при добавлении в раствор 2 % сахарозы срок сохранения срезанных гвоздик составил 14–15 дней.
Простой и эффективный способ хранения срезанных цветов в вазе с водой заключается в предварительном выдерживании стеблей в растворе отработанного фиксажа.
В этом случае свежесрезанные цветы выдерживают в фиксаже 30–40 мин, погрузив их стебли на 10–15 см в жидкость. Поставленные затем в воду при комнатных условиях цветы сохраняют свои декоративные качества в течение 2–3 недель в зависимости от вида.
ХРАНЕНИЕ ЦВЕТОЧНОЙ ПРОДУКЦИИ С ПРИМЕНЕНИЕМ ФИЗИКО-ХИМИЧЕСКИХ СРЕДСТВ
Наряду с применением специальных многокомпонентных, комбинированных химических средств и препаратов используют простейшие вещества и препараты, улучшающие сохранность цветочной продукции как при холодильном хранении, так и в комнатных условиях.

ГСЭМТ с поглотителями
Наиболее простой метод сохранения срезанных цветов при небольших объемах хранения заключается в срезке цветов в период полуроспуска с последующим обновлением среза под водой на 1–2 см. Затем концы стеблей цветов до 2–3 раз погружают на 2–3 см в расплав парафина. Цветы, сформированные по 3–5 штук в букеты, размещают в вертикальном положении в предварительно стерилизованную банку. Горловину банки герметизируют, например полимерной крышкой, и обмазывают пластилином. Цветы в банке, установленной на горловину, размещают в темном прохладном месте и хранят при температуре 10–17 °C. Срок хранения отдельных видов цветов при этом значительно выше, чем при традиционных методах.
Для поддержания тургора срезанных цветов и сохранения их качества при влажном способе хранения в холодильных и комнатных условиях рекомендуется использовать перепад давлений в сообщающихся сосудах, находящихся на разновысоком уровне (Яриновский, 1980). В простейшем случае один или несколько срезанных цветов, сформированных в букет, со свежеобновленным под водой срезом вставляют на 2–3 см в шланг из мягкой резины. Другой конец шланга помещают в сосуд с водой. Подняв сосуд с водой на уровень выше места стыка цветов со шлангом, прослеживают, чтобы часть воды выступила через поры стыка наружу. Затем место стыка герметизируют, например пластилином, и фиксируют цветы с сообщающимся сосудом на разных уровнях для поддержания необходимого подпора жидкости к срезу цветов. Для придания воде свойств питательной жидкости в нее добавляют сахар.
Известен способ увеличения продолжительности жизни срезанных цветов в вазе с водой (Sacalis, 1974), заключающийся в установке каждого цветка или группы их в трубчатый держатель, заполненный в нижней части гранулами анионообменной смолы или смесью катионо- и анионообменной смол (рис. 11). Трубчатый держатель, в таком виде погруженный нижней частью в воду, обеспечивает поступление воды к срезу стебля цветка за счет капиллярного эффекта только после ее прохождения через очищающий слой смолы. Этот метод позволяет увеличить время жизни цветов в вазе до девяти дней по сравнению с пятью днями в контроле.

Рис. 11. Схема хранения срезанных цветов с использованием ионообменных смол: 1 — стебель цветка; 2 — держатель; 3 — наполнитель (смола); 4 — вода в сосуде
К перспективному направлению хранения цветочной продукции относится применение для этих целей анти-транспирантов (Хватова, 1982). Антитранспирантами служат синтетические латексы, различные по своей химической природе. Из отечественных наиболее известны бутилкаучуковый и дивинилметилметакрилатный латексы, из зарубежных — сополимерная дисперсия ацетата-акрилата (S-789), модифицированная эмульсия поливинилхлоридного латекса (S-600), препараты ОЕД, Adol-52 и др. Латексы недороги, нетоксичны для растений, биологически нейтральны, легко распыляются через опрыскиватель, устойчивы при хранении и транспортировке. После опрыскивания или обмакивания растений (цветов, черенков, луковиц и т. д.) в раствор латекса на поверхности их образуется тонкая (0,01—0,02 мм) прозрачная пленка, имеющая значительную прочность, эластичность и высокую гидрофобность (нерастворимость в воде и несмываемость дождем). Латексные пленки устойчивы к ультрафиолетовой радиации, окислению, воздействию микроорганизмов, обладают паропроницаемостью, достаточно пористы, что обеспечивает газообмен растительного объекта со средой. Разрушаются латексы постепенно под влиянием атмосферных факторов и механических воздействий.
Испытания препаратов на основе отечественных синтетических латексов — дивинилметилметакрилатного и хлоропренового — показали, что обработка черенков таких культур, как сирень, роза и другие, латексами (концентрация раствора 1:8 и 1:1) уменьшает влагопотери, увеличивает продолжительность хранения черенков до 12–56 дней против 7—19 в контроле. Укореняемость черенков роз составила через 35 дней после обработки и хранения 48–84 % при 40 % в контроле. Сейчас латексы начинают применять для сохранения срезанных цветов и луковиц.
Для продления жизни срезанных цветов и черенков при хранении сухим и влажным способом в холодильнике и комнатных условиях эффективно использование различных гранулированных или таблетированных химических веществ и препаратов, таких как этисорб, мета-бисульфит калия, активированный уголь в чистом виде и пропитанный бромом.
Препарат этисорб широко применяют за рубежом при хранении и перевозках цветочной и плодоовощной продукции. Он представляет собой пористый носитель с развитой активной поверхностью (оксид алюминия), пропитанный марганцовокислым калием. За рубежом выпускают гранулированный этисорб в виде капсул-фильтров и в виде запаянных полимерных пакетиков с перфорацией. Препарат нетоксичен и неедок, не оставляет на продукции налета и запаха, надежен и прост в обращении, обладает повышенной способностью поглощения этилена.
В зависимости от массы продукции, заложенной на хранение, и степени ее зрелости при известной этилен-поглотительной способности препарата легко рассчитать необходимое его количество. Установлено, что этисорб способен продлить сроки хранения продукции более чем на 50 % по сравнению с традиционными видами хранения.
Пакетики с препаратом размещают в таре с хранящейся или транспортируемой цветочной продукцией. При больших объемах единовременного хранения применяют специальные устройства и установки с прокачкой воздуха в хранилище через барабан, наполненный этисорбом (общая масса препарата — до 7 кг). Срок активного действия этисорба зависит от уровня этилена и может достигать шести месяцев.
Этисорб позволяет также адсорбировать из атмосферы хранилища с продукцией такие нежелательные компоненты, как диоксид серы и сероводород.
В нашей стране разработан аналогичный препарат — сорбилен, который отличается более высокой способностью поглощения этилена и других газовых компонентов, сопутствующих старению цветочной продукции. Препарат может быть изготовлен как в виде крупнозернистого порошка, так и в виде гранул, упаковывают его в перфорированные полиэтиленовые пакетики. Модификации препарата предусматривают использование отличных от оксида алюминия носителей с развитой активной поверхностью, более дешевых и эффективных по результатам хранения цветочной продукции.
За рубежом для хранения цветов используют также метод нейтрализации этилена с применением мобильной установки Оннинен ОЕС-40 для его удаления. При этом происходит каталитическое разложение этилена и других углеводородов в реакторе с платиновой насадкой сотового типа, через который прокачивают с подогревом газовый поток из хранилища. Установка позволяет также нейтрализовать посторонние запахи и токсичные газообразные органические выделения. Нормальная мощность расхода прокачиваемого через установку Оннинен ОЕС-40 воздуха — 40 м
3/ч, степень поглощения этилена — до 95 %, общий расход электроэнергии — 450 Вт. Габариты установки 35×35×108 см, масса 75 кг.
ХРАНЕНИЕ СРЕЗАННЫХ ЦВЕТОВ И ЧЕРЕНКОВ ПРИ ПОНИЖЕННОМ ДАВЛЕНИИ
Промышленное хранение цветочной продукции в условиях пониженного давления, применяемое за рубежом, свидетельствует о возможности значительно увеличить срок хранения срезанных цветов и черенков по сравнению с содержанием их только в холоде при нормальном давлении.
Технология гипобарического хранения основана на следующих явлениях. Известно, что коэффиценты диффузии газов из растительных тканей обратно пропорциональны давлению атмосферы. Так, если в закрытой камере с заложенной на хранение растительной продукцией (черенками, цветами и т. д) давление довести до 76 мм рт. ст. (10,1 кПа), то это в 10 раз ускорит выход углекислоты и этилена из растительных клеток в межклеточное пространство и затем наружу. Причем постоянное удаление этих газов не увеличивает образования их в тканях, а вывод из растений в атмосферу способствует длительному хранению продукции.

Хранение черенков в укрупненной пленочной упаковке с ГСЭМТ
Интенсивность выделения этилена растет по мере старения тканей. Снижение давления в емкостях для хранения уменьшает также содержание в атмосфере и межклеточном пространстве кислорода, что замедляет процессы метаболизма, особенно дыхание, тормозит развитие микрофлоры. В тканях образуется меньше этилена, что, в свою очередь, значительно снижает их чувствительность к действию ранее образовавшегося газа. Замедление дыхания сдерживает разложение и использование растениями запасных веществ, тем самым сохранность продукции продлевается. Таким образом, выделение этилена цветами и реакция на этот газ — важнейшие факторы, регулирующие процессы старения. Поэтому постоянное удаление его из растений и черенков в условиях низкого давления резко повышает устойчивость продукции при хранении.
Эффективность данного метода снижается при уменьшении в вакууме количества водяных паров, что ускоряет иссушение растений. Чтобы предотвратить это явление, необходимо постоянно увлажнять воздух в хранилище. Данные исследований по хранению цветочной продукции при пониженном давлении представлены в таблице 8. Лучшие результаты, как видно из таблицы, получены при снижении давления в контейнерах до 40–60 мм рт. ст. (5,33—8 кПа) при постоянном потоке увлажняемого воздуха с 1—2-кратным обменом в течение часа. Количество его должно соответствовать массе продукции, интенсивности дыхательных процессов и температуре в контейнерах.
Посадочный материал хризантем, гвоздик, пеларгоний сохраняется в контейнерах с пониженным давлением в 2–3 раза дольше, чем в холодильных камерах. Черенки после хранения при пониженном давлении укоренялись и развивались в те же сроки, что и свежие, а растения, полученные из них, росли и продуцировали нормально. Для роз сорта Белинда, например, при пониженном до 47 мм рт. ст. (6,3 кПа) давлении, температуре 3 °C и относительной влажности воздуха 98 % характерны следующие сроки хранения и последующей устойчивости в вазе при комнатной температуре (Bredmose, 1980). Розы, срезанные в период роспуска, при сроке хранения 21 день живут в вазе пять дней, а срезанные в начале бутонизации сохраняются в вазе восемь дней. Лучшие результаты дает хранение роз в полуроспуске при дополнительной их упаковке в тонкую (0,04 мм) полипропиленовую пленку. В этом случае полноценные цветы в роспуске живут в вазе до восьми дней, что соответствует по срокам устойчивости условию шестидневного хранения при атмосферном давлении в холоде (3 °C) и относительной влажности воздуха 98 %. Нужно иметь в виду, что после 40–45 дней хранения при пониженном давлении время жизни в вазе падает до 2–3 дней.

Таблица 8. Показатели хранения цветочной продукции традиционным и вакуумным методами
В последние годы стали применять комбинированный способ хранения срезанных цветов, заключающийся в предварительной обработке их раствором консерванта с последующим размещением непосредственно на хранение при пониженном давлении или с промежуточным хранением в холоде при нормальном давлении (Staby, 1984). В этом случае срезанные цветы рекомендуется предварительно охладить до 3–4 °C, затем розы поместить на 2 ч в 2 %-й раствор сахарозы температурой 20–21 °C, гвоздики — на 1 ч в раствор тиосульфата серебра температурой 24–26 °C.
Гвоздика может сохранять свою жизнеспособность при хранении в холоде и нормальном давлении шесть недель с последующим ее хранением в течение восьми недель при пониженном до 10–40 мм рт. ст. (1,33— 5,33 кПа) давлении. Коробки с цветами в период хранения при обычном давлении должны быть выстланы тонкой полиэтиленовой пленкой во избежание излишних влагопотерь. Это условие справедливо и для срезанных роз, которые можно хранить до двух недель при обычном давлении и затем до четырех недель при пониженном. Следует отметить, что устойчивость цветов в вазе после такого хранения сокращается на 30–40 % по сравнению со свежесрезанными нехранившимися цветами.
Отечественный опыт хранения срезанных цветов при пониженном давлении около 100 мм рт. ст. (13,3 кПа) и температуре 1–3 °C показывает возможность сохранения пионов в бутонах до двух месяцев против 7—10 суток при температуре 4–6 °C и нормальном атмосферном давлении. Гвоздики сохраняются 60–90 суток, а для хризантем и роз этот показатель в 2–3 раза выше, чем при хранении в нормальной атмосфере (Писарев, 1984).
Технология хранения включает следующие операции. С помощью холодильных машин доводят температуру в камере до необходимого уровня 2 °C. В барометрический модуль загружают цветочную продукцию и двери герметизируют. С помощью вакуум-насоса устанавливают требуемое давление в камере хранения. От специальной установки по воздухоподготовке к цветам подается увлажненный воздух необходимого состава. Этот процесс регулируется вентильным устройством. Предусмотрено удаление из камеры летучих веществ, выделяемых растениями (этилен и др.). Перед снятием цветов с хранения давление в баромодуле уравнивают с атмосферным с помощью специального вентиля.
Широкое применение гипобарического метода хранения в цветоводческих хозяйствах сдерживается рядом объективных обстоятельств. Разница давлений внутри и снаружи камеры хранения, достигающая 760 мм рт. ст. (101,3 кПа), вызывает нагрузку на ее стенки до 10 т/м
2. Это требует применения дорогих и высокопрочных материалов и конструкций, а следовательно, и больших единовременных затрат на строительство. Сложна и дорога аппаратура автоматики и контроля, эксплуатировать которую должен высококвалифицированный обслуживающий персонал.
Методы хранения черенков, луковиц, другого посадочного материала и цветов «поливакстер» и «биологический вакуум» близки по технологии. Они основаны на хранении при пониженном давлении в сочетании с модифицированной газовой средой. Эти методы слабо изучены и почти не использовались в промышленном цветоводстве, хотя известно успешное их применение при хранении продукции садоводства и овощеводства. Трудоемкость этих методов невысока, и можно сделать заключение о положительном эффекте их использования в цветоводческих хозяйствах при хранении черенков и посадочного материала цветочных культур.
Сущность метода биологического вакуума заключается в том, что за счет дыхания растительной продукции, заложенной на хранение, и газопроницаемости полимерной пленки, входящей в состав упаковки, в емкости для хранения устанавливается состав атмосферы с повышенным содержанием С02 (чаще всего от 5 до 7 %). В то же время количество кислорода резко сокращается и упаковка с продукцией вакуумируется естественным образом. При выполнении упаковки из полиэтиленовой пленки продукция как бы обволакивается материалом упаковки. Хранение проводят при температуре 0–2 °C.
Метод хранения «поливакстер» (полиэтиленовая пленка, вакуум в единице упаковки и термическая обработка упаковочного материала) похож на метод биологического вакуума и отличается тем, что вакуум создают искусственно, путем принудительной откачки воздуха из упаковки с последующей заваркой полиэтиленовой пленки. Пакеты с продукцией затем помещают на 12–15 мин в емкость с теплой водой (40–45 °C), после чего на такое же время — в емкость с холодной (1–5 °C). После охлаждения пакеты с продукцией укладывают в ящики (пакеты с цветами можно устанавливать в глубокие картонные коробки) и хранят при температуре 1–5 °C. Практика применения рассмотренных способов хранения свидетельствует о возможности сохранения качества растительной продукции в течение 2–2,5 месяца.
За рубежом, в особенности во Франции и Японии, находит применение метод комбинированного хранения в холоде с предварительным охлаждением путем вакуумирования цветочной продукции, заложенной в тару (пленочные упаковки, картонные коробки с пропиткой и др.).
Согласно технологии, например, срезанные цветы в полуроспуске или черенки загружают сразу после сбора в специальную камеру, где подвергают вакуумированию с разрежением 6–7 мм рт. ст. (0,8–0,9 кПа). Это позволяет за 20–30 мин равномерно по всей массе продукции снизить ее температуру от комнатной до температуры холодильного хранения. Несмотря на достаточно быстрое охлаждение, появление конденсата и капельной влаги на цветах и черенках исключается, что снижает вероятность возникновения микробиологической порчи их, а также физиологических повреждений. После предварительного вакуумного охлаждения продукцию направляют на последующее холодильное хранение или транспортируют к месту реализации.
Система предварительного вакуумного охлаждения позволяет за 5—10 мин снизить температуру 4–5 кг срезанных цветов хризантем, гвоздик и роз, упакованных в перфорированные пленочные пакеты, с 17 до 0–1 °C при влагопотерях продукции 1–2,5 %.
Длительность последующего хранения срезанных цветов в холоде в 1,5–2 раза выше по сравнению с традиционным холодильным хранением сухим способом.
Снятые с хранения цветы полностью распускаются в вазе и сохраняют свою устойчивость при комнатной температуре в течение 5–7 дней.
ХРАНЕНИЕ ЦВЕТОВ И ЧЕРЕНКОВ С ИСПОЛЬЗОВАНИЕМ АЭРООЗОННОЙ ОБРАБОТКИ
Одним из новых и перспективных методов хранения растительной, в том числе и цветочной, продукции является способ аэроозонной обработки, разработанный в последние годы (Рукавишников, 1983; Стрельцов, 1984). Способ применим как при сухом, так и при влажном хранении срезанных цветов и черенков. Он эффективен также при хранении луковиц, клубнелуковиц и корневищ.

Розы в теплице
В основу способа положена особенность озона оказывать антисептическое, фунгицидное, бактерицидное и дезодорирующее действие на обрабатываемый материальный объект (Колодязная, 1974, Schwarzbach, 1982). Существенное преимущество озона при хранении растительной продукции заключается в том, что он служит активным разрушителем этилена (см. главу 1).
Для хранения цветочной продукции применяют предварительную аэроозонную обработку емкостей для цветочного материала, а также обработку продукции в процессе хранения. Такую обработку можно проводить путем непосредственной подачи аэроозонной газовой смеси в емкость или в массу подготавливаемой для хранения продукции.
В комнатных условиях в сухом и чистом воздухе распад озона идет достаточно медленно. За 10 ч его концентрация плавно падает лишь в 1,5 раза. При понижении температуры устойчивость озона к распаду увеличивается.
Предварительная обработка полимерных пленочных упаковок с последующим размещением в них срезанных цветов и черенков и хранением с открытой горловиной в холоде (1–6 °C) показала, что озон способствует сохранности продукции за счет антисептирующего действия внутри емкости. Результаты хранения срезанных цветов в полуроспуске и стеблевых черенков гвоздики ремонтантной по сравнению с хранением без обработки улучшаются в 1,3–1,5 раза в зависимости от сорта. Тормозится развитие грибных заболеваний цветочной продукции. В то же время при экспозиции более 30 с и концентрации озона в аэроозонной смеси свыше 1,5 мг/м
3 происходит изменение окраски лепестков цветочных бутонов (обесцвечивание, а в ряде случаев «ожог» остаточным озоном). Наиболее устойчивы к изменениям гвоздики красных тонов. В этой связи не рекомендуется непосредственная обработка срезанных цветов озоном, в то время как обработка стеблевых черенков способствует их сохранности.
Указанное обстоятельство послужило причиной для поиска новых технических решений по использованию аэроозонной обработки для хранения цветов. В результате этой работы был предложен высокоэффективный способ влажного хранения срезанных цветов в водной среде. При его разработке была использована способность озона хорошо (примерно в 10 раз лучше, чем кислорода) растворяться в воде, что создает предпосылки пролонгированного антисептического действия на микрофлору как воды, так и погружаемых в нее объектов (Разумовский, 1979).
Эффект антисептического воздействия озона на воду достаточно хорошо изучен. Период полураспада озона в воде составляет от 10 до 25 мин в зависимости от чистоты воды и ее температуры. В загрязненной и теплой воде процесс распада идет интенсивнее, чем в охлажденной и чистой. Характер зависимости распада озона при комнатных условиях в дистиллированной воде от его концентрации представляет собой убывающую экспоненту. Через 20 мин концентрация озона падает с 2,6 до 1,6 мг/л, а через 1 ч — до 0,7 мг/л.
Наличие озона в воде характеризуется коэффициентом распределения, или растворимости, выражающим отношение концентрации озона в воде при данной температуре и давлении к концентрации озона в аэроозонной смеси.
Обычно озонирование воды проводят путем барботирования ее толщи с использованием ультразвуковых, керамических и решетчатых насадок-барботеров, располагаемых у дна емкости с водой. Установлено, что для режима барботирования, насыщения и антисептирования воды оптимальный диаметр пузырька аэроозонной смеси, поступающей в воду, составляет около 1,5 мм. Исходя из этого и выбирают конструкцию барботеров.
Средняя концентрация озона для антисептирования достаточно чистой воды равна около 1 мг/л при времени обработки до 15 мин. Полное обеззараживание питьевой воды гарантировано при концентрации озона около 2,5 мг/л и времени обработки не менее 10 мин. Согласно новому способу влажного хранения срезанных цветов, их рекомендуется выдерживать сразу после срезки и удаления нижних листьев в воде, насыщенной озоном, погрузив до бутонов. В зависимости от качества воды и вида срезанных цветов насыщенность воды озоном должна составлять от 0,5 до 3,9 мг/л при времени экспозиции от 10 мин до 1 ч. В этом случае озон, растворенный в воде, уничтожает микрофлору на стебле и листьях цветов, препятствует блокировке сосудов стебля и разрушает этиленоподобные вещества, выделяемые растениями. После предварительной обработки цветы ставят на длительное хранение в озонированную аналогичным образом воду, погружая стебли на 10–15 см.
Более простой вариант этого способа влажного хранения предусматривает помещение срезанных цветов в озонированную воду (при концентрации озона 0,5–3,9 мг/л) сразу после срезки без предварительной обработки. Возможно хранение цветов подобным способом и после транспортировки, при этом желательно обновление среза под водой.
Лучшие результаты получены при периодическом озонировании воды в емкости для хранения один раз в 3–5 дней. На время аэроозонной обработки воды цветы рекомендуется из емкости удалять во избежание «ожога» бутонов озоном высокой концентрации.
Если цветы остаются в емкости с водой, то можно снизить время обработки и концентрацию озона в аэроозонной смеси для насыщения воды или изолировать бутоны цветов от проскакивающих пузырьков озона.
При температуре 1–6 °C срок хранения срезанных в полуроспуске и в состоянии плотных бутонов цветов розы в озонированной воде достигает 25–28, гвоздики — 40–45 дней. Гладиолусы сохраняют свое качество в аналогичных условиях до 35–40 дней. В комнатных условиях срок хранения сокращается в 1,5–2 раза.
Длительность хранения стеблевых черенков и срезанных цветов гвоздики при сухом методе хранения можно существенно увеличить, если предварительно обработать их озонированной водой. В этом случае черенки и цветы выдерживают в течение 1–1,5 ч в воде, насыщенной озоном (концентрация 0,5–3,9 мг/л), затем после удаления капельной влаги размещают в полиэтиленовые пакеты с открытой горловиной и хранят при 0–2 °C.
Качество стеблевых черенков существенно не изменяется даже через 3,5–4 месяца хранения. Цветы гвоздики, срезанные в окрашенных, слегка открытых бутонах, сохраняют свои декоративные качества в вазе 7–9 дней после 2,5–3 месяцев хранения. При всех модификациях хранения срезанных цветов гвоздики с применением аэроозонной обработки лучше сохраняются сорта с красной окраской бутонов (типа Ред Сим и др.).
Значительное улучшение результатов хранения как срезанных цветов, так и черенков дает сочетание аэроозонной обработки и использования модифицированной газовой среды.
ГЛАВА 4. ХРАНЕНИЕ ЦВЕТОЧНОЙ ПРОДУКЦИИ В РЕГУЛИРУЕМОЙ И МОДИФИЦИРОВАННОЙ ГАЗОВОЙ СРЕДЕ
Один из наиболее эффективных методов обеспечения стабильности качества растительной и цветочной продукции — хранение ее в условиях регулируемой газовой среды (РГС) в сочетании с холодом.
Регулируемая газовая среда, совершенствуя и дополняя условия обычного холодильного хранения, позволяет в 2–3 раза снизить потери, лучше сохранить товарное качество и продлить сроки хранения свежей растительной продукции. Способы хранения в условиях РГС основаны на регулировании искусственным или естественным путем содержания в камерах с продукцией основных газовых компонентов: кислорода, углекислого газа и азота.
В практике хранения принято различать регулируемую газовую среду (РГС) и модифицированную газовую среду (МГС). РГС создают и поддерживают искусственным путем за счет сжигания природного газа, подачи его из баллонов или газогенераторов различного типа. МГС создается естественным путем самой заложенной на хранение продукцией в результате газообмена ее с атмосферой через газоселективные материалы и элементы упаковок или контейнеров, МГС можно считать разновидностью регулируемой газовой среды.
ХРАНЕНИЕ ЦВЕТОЧНОЙ ПРОДУКЦИИ В РГС
Метод хранения в РГС разработан на основе изучения газообмена хранящейся продукции с окружающей средой. Известно, что в условиях холодильного хранения концентрация кислорода в межклеточном пространстве продукции всегда меньше, чем в окружающей среде, а углекислого газа — больше. Разность парциальных давлений вызывает диффузию газов через поверхностные ткани растительных объектов. С учетом этого обстоятельства при повышении концентрации углекислого газа в окружающей среде и снижении содержания кислорода можно соответственно увеличить концентрацию углекислого газа, а кислорода в межтканевом пространстве продукции уменьшить и тем самым снизить интенсивность ее дыхания (Метлицкий, 1976; Колесник, 1983).
Благодаря снижению интенсивности дыхания, а следовательно, и тепловыделения при хранении продукции в РГС температурный режим можно поддерживать на 2–5 °C выше обычного. Это позволяет предупредить возникающие при низкой температуре заболевания и поражения продукции, а также снизить затраты на холод.
Успешное хранение в РГС во многом определяется правильным подбором газовой среды для каждого вида и сорта заложенной на хранение продукции. Часто для хранения применяют так называемые нормальные газовые смеси, в которых суммарная концентрация кислорода и углекислого газа составляет 21 %. Наиболее распространены смеси этого типа с содержанием 5—10 % углекислого газа, 16–11 % кислорода и 73 % азота. Тормозящее дыхание растений — действие, обеспечиваемое нормальными газовыми смесями, — основано на высокой концентрации углекислого газа, предельно рекомендуемое значение которой не превышает 10 %.
Более эффективны субнормальные газовые смеси, где суммарная концентрация углекислого газа и кислорода ниже 21 %. Наиболее часто используют субнормальные смеси, в которых содержится 3–5 % кислорода, 0–5 % углекислого газа и 90–97 % азота. Подобные смеси задерживают созревание продукции и приостанавливают развитие функциональных расстройств в результате одновременного значительного обеднения среды кислородом и обогащения ее углекислым газом. Для хранения продукции, особенно чувствительной к углекислому газу, иногда применяют субнормальные газовые смеси с минимально допустимой концентрацией кислорода 2–3 % (на грани анаэробного дыхания) при отсутствии углекислого газа или содержании его в очень небольшой концентрации (менее 1–2 %). Эти смеси в меньшей степени замедляют дыхание продукции, чем указанные выше, их используют ограниченно. Подобные субнормальные смеси применяют обычно при температуре, близкой к 0 °C, и относительной влажности воздуха 90–95 %. Понижение температуры в условиях повышенной влажности увеличивает чувствительность продукции к углекислому газу.
В рекомендациях Международной организации по стандартизации (ИСО) приведены четыре наиболее характерных типа газовых смесей для хранения в условиях РГС (Янюк, 1984). Состав этих смесей дан в таблице 9. Газовые смеси I и III типов относятся к субнормальным, а II и IV типов — к нормальным.

Таблица 9. Состав газовых сред для хранения растительной продукции, %
Следует отметить, что существуют определенные предельно допустимые значения концентраций кислорода и углекислого газа, обусловленные биохимическими особенностями хранения цветочной продукции. Для кислорода предельное значение — 2 % (минимум), для углекислого газа — 10 % (максимум). Технологическая схема хранения цветов в РГС представлена на рисунке 12.

Рис. 12. Схема хранения срезанных цветов в РГС: 1 — срезка цветов; 2 — предварительное охлаждение; 3 — размещение цветов в камере и хранение в РГС
На основе данных, полученных различными исследователями (Кельцев, 1984), установлен следующий оптимальный режим хранения срезанных цветов в РГС, создаваемой в стационарных камерах хранения: состав газовой среды — 2 % углекислого газа, 1 % кислорода, 97 % азота; температура хранения 0 °C.
Параметры хранения в РГС отдельных видов цветов сведены в таблице 10 (Семашко, 1984).

Таблица 10. Режимы и сроки хранения срезанных цветов в РГС
Исследования зарубежных специалистов по хранению срезанных цветов гвоздики с применением РГС (Рrаtella, 1968) в широком диапазоне концентраций компонентов: углекислого газа от 0 до 20 % и кислорода от 1 до 13 % при температуре 0 °C и относительной влажности воздуха более 90 % показали, что оптимальные отношения концентраций углекислого газа к кислороду составляют: 5:3, 5:1, 20:3. При таких концентрациях газовой смеси после снятия с хранения цветочной срезки отмечена максимальная устойчивость ее в вазе в комнатных условиях. Лучшие результаты при длительном хранении получены для отношения углекислого газа к кислороду, равного 5:3. После длительного хранения (45 дней) цветы сохранялись в вазе 5–6 дней.
К разновидности хранения цветочной продукции в искусственно создаваемой среде относится способ нагнетания необходимой газовой смеси в полимерные упаковки с продукцией, входные отверстия которых затем заваривают. За рубежом для такого хранения используют тару из пластика и сумки из фольги размером 800×470×1500 мм. Необходимое условие — герметичность тары, в которую свободно умещается, например, до ста гвоздик. Цветы в этом случае хранят и транспортируют в условиях постоянной влажности, создаваемой внутри упаковки в процессе дыхания продукции, при этом тара обеспечивает сохранение физического состояния цветов, что дает возможность хранить в ней такие хрупкие цветы, как нарциссы, тюльпаны и др. (табл. 11).

Таблица 11. Показатели хранения срезанных цветов в фольгированных упаковках в РГС
В практике цветоводства в нашей стране была разработана модификация данного способа. Согласно этой технологии, срезанные цветы упаковывают в толстостенный (150–200 мкм) полиэтиленовый мешок, затем горловину мешка частично заваривают и в него через специально вмонтированный штуцер нагнетается необходимая газовая смесь, после чего мешок окончательно наглухо заваривается. Срезку цветов в такой упаковке хранят на стеллажах в горизонтальном положении при температуре окружающей среды не выше 0,5 °C или в отсеках хранилища в вертикальном положении при той же температуре. Допускается штабельное хранение при предварительной укладке каждой упаковки в картонные коробки со стружкой либо мелконарезанной бумагой. Разнообразие режимов хранения в РГС некоторых видов цветочной продукции в сравнении с плодоовощной иллюстрирует рисунок 13.

Рис. 13. Карта режимов хранения некоторых видов цветочной продукции в указанном диапазоне селективностей мембраны (для сравнения приведены режимы хранения некоторых видов плодоовощной продукции)
Хранение срезанных цветов в упаковках с искусственным наполнением газовой смесью показывает возможность сохранения высоких товарных качеств продукции цветоводства в течение периода от недель до нескольких месяцев в зависимости от вида и сорта цветочной культуры.
Известен также способ принудительного снижения концентрации кислорода путем подачи в камеру хранилища газообразного или жидкого азота. Концентрация углекислого газа повышается при этом естественным образом за счет дыхания заложенной на хранение продукции. Чтобы концентрация С0
2 не превышала допустимых уровней (более 10 %), газовую смесь периодически пропускают через скруббер — поглотитель избыточного количества СО
2. Снижение концентрации кислорода в камере до 6 % происходит за 3 ч, а достижение заданного режима хранения — за 5 суток при расходе на 1 м
3 камеры от 1,7 до 1,8 л жидкого азота или 1,25 м
3 газообразного. Срок хранения растительной продукции при этом составляет 2–2,5 месяца.
Хранение срезанных цветов в атмосфере чистого азота или в сочетании с малым количеством кислорода (до 1,5 %), по данным В. Н. Нечипоренко, благоприятно сказывается на качестве продукции при хранении и транспортировке, увеличивает продолжительность жизни цветов в вазе на 3–4 дня. При этом азот может подаваться как в специальные камеры и рефрижераторные отсеки, так и толстостенные полимерные упаковки, хранение ведется на холоду. При температуре хранения 0–2 °C для гвоздики рекомендуется газовая среда, состоящая из 0,5–1,2 % кислорода, для гладиолусов — 1 % кислорода, остальной объем в обоих случаях занимает азот.
Все методы хранения в РГС растительной, в том числе и цветочной, продукции, несмотря на хорошие результаты, весьма сложны в реализации, требуют больших единовременных затрат на сооружение герметичных камер и сложной аппаратуры контроля и управления. В этой связи рассмотренные методы имеют пока ограниченное применение для хранения цветочной продукции.
ГАЗОСЕЛЕКТИВНЫЕ МАТЕРИАЛЫ ДЛЯ СОЗДАНИЯ МОДИФИЦИРОВАННОЙ ГАЗОВОЙ СРЕДЫ
Использование модифицированной газовой среды — самый доступный и в то же время эффективный для промышленного цветоводства метод хранения продукции из всех способов хранения в газовых средах. При создании и поддержании МГС используют свойства селективной проницаемости или самого материала упаковки (обычно тонкие полимерные пленки), или газоселективного элемента мембранного типа (ГСЭМТ) в виде вставки (окна) в боковые стенки контейнеров и упаковок, или специальных устройств, которыми оснащают газонепроницаемые контейнеры и упаковки для хранения.
Основной рабочий орган ГСЭМТ — мембрана. Обычно она представляет собой технологическую перегородку, обеспечивающую вследствие селективной проницаемости разделение газовых смесей без химических превращений. Разделение газовых смесей с использованием мембранной технологии происходит на основе диффузионного процесса, движущей силой которого могут быть перепад давлений и градиент концентрации. Для диффузионного разделения газов применяют мембраны, имеющие различную проницаемость по отношению к отдельным компонентам газовых смесей.
Высокоэффективны и перспективны для целей газодиффузионного разделения — асимметричные мембраны, представляющие собой материалы с анизотропной по толщине структурой. Асимметричные мембраны изготавливают, как правило, из одного полимера или смеси полимеров. Эти мембраны имеют плотный верхний слой и рыхлую структуру нижнего слоя. Плотный слой мембраны определяет ее селективность для того или иного компонента смеси, а пористая ее часть служит несущей подложкой.
Важнейшие требования, предъявляемые к мембранам, следующие: высокая разделяющая способность, высокая удельная производительность, инертность по отношению к компонентам разделяемой смеси, стабильность свойств во времени, низкая стоимость. Критерием соответствия мембран назначению служит оценка их при эксплуатации, однако обычно предварительно рассматривают такой важный показатель, как проницаемость мембран.
Оценка эксплуатационных свойств мембран, предназначенных для диффузионного разделения газов, в основном сводится к определению проницаемости для различных компонентов газовых смесей.
Для хранения цветочной продукции в МГС необходимо предварительно провести следующую работу:
исходя из параметров мембран (проницаемость, селективность и др.) и параметров закладываемой на хранение продукции (интенсивность дыхания, дыхательный коэффициент и т. д.) определить область принципиально возможных режимов хранения;
разработать методику определения параметров стационарного режима хранения и перехода на стационарный режим хранения;
на основе проведенных теоретических расчетов подобрать подходящие газоселективные мембраны;
сконструировать необходимые контейнеры с ГСЭМТ; испытать контейнеры с ГСЭМТ в реальных условиях хранения.
Со значением общей проницаемости мембраны связаны значения безразмерного параметра о — селективности, который представляет собой отношение фильтрации одного газа к величине фильтрации другого газа при одном и том же давлении и служит мерой избирательности мембраны по отношению к соответствующим газам. Для большинства полимерных материалов мембранного типа с уменьшением проницаемости возрастает селективность (СО
2/О
2), и наоборот.
В таблице 12 приведены данные характеристики проницаемости полимеров для некоторых газов при комнатной температуре (Дубяга, 1981). Обычно газоселективные мембраны классифицируют по методу их получения, геометрической форме, назначению, структурным особенностям и материалу, из которого они изготовлены.

Таблица 12. Газопроницаемость различных материалов
ОСНОВЫ СОЗДАНИЯ МОДИФИЦИРОВАННОЙ ГАЗОВОЙ СРЕДЫ ДЛЯ ХРАНЕНИЯ ЦВЕТОЧНОЙ ПРОДУКЦИИ
Если в герметизированном контейнере с ГСЭМТ находится свежая цветочная продукция, то через некоторое время внутри контейнера вследствие дыхательных процессов и диффузии газов сквозь мембрану сформируется атмосфера, газовый состав которой можно регулировать, подбирая площадь мембраны, ее проницаемость и селективность.
Зная характеристики мембран и параметры дыхания цветочной продукции, можно рассчитать оптимальную для данного количества цветов упаковку или контейнер с ГСЭМТ.
Саморегулируемая МГС в загруженной продукцией упаковке или контейнере с
пониженным по сравнению с атмосферным содержанием кислорода и повышенным — углекислого газа представляет собой сумму балансируемых концентраций кислорода и углекислого газа, проникающих как снаружи внутрь, так и изнутри наружу через газоселективную мембрану. Вследствие снижения давления кислорода внутри упаковки, вызываемого расходом его на дыхание продукции, создаются благоприятные условия дальнейшей диффузии кислорода из атмосферы внутрь упаковки. Это способствует поддержанию на заторможенном уровне метаболических процессов в цветочной продукции. Выделяемый при этом избыток углекислого газа диффундирует в атмосферу.
Положительный эффект действия модифицированной газовой среды на сохраняемость цветочной продукции обусловлен рядом факторов. Снижается интенсивность дыхания, замедляются биохимические процессы старения растительных клеток и тканей, повышается устойчивость против физиологических и фитопатогенных заболеваний, сокращаются расход питательных веществ и испарение влаги. В результате этого продлеваются сроки хранения, увеличивается выход качественной продукции после хранения, до минимума сокращаются потери массы цветов, лучше сохраняются в них биологически активные вещества.
Для стеблевых черенков сочетание благоприятных факторов хранения способствует образованию у них кал-люса и корневых зачатков. Это, в свою очередь, приводит к активному укоренению черенков и сокращению их потерь после хранения (Рукавишников, 1982).
Процесс создания и поддержания модифицированной газовой среды описывается рядом уравнений, применение которых в практике позволяет значительно сократить время отработки оптимальных режимов и разработки новых средств хранения в МГС. В этой связи теоретическое обоснование метода хранения в МГС представляет практический интерес для цветоводства.
При хранении растительной, в том числе и цветочной, продукции в МГС уменьшение объема кислорода в контейнере или упаковке пропорционально массе заложенной на хранение продукции и интенсивности ее дыхания. Последняя, в свою очередь, будет пропорциональна произведению значения первоначальной интенсивности дыхания на концентрацию кислорода, выражаемую отношением текущего объема кислорода к первоначальному его объему. Поступление кислорода в контейнер извне пропорционально площади мембраны S, разности парциальных давлений этого газа вне и внутри контейнера и проницаемости мембраны по кислороду Р. Процессы поступления и поглощения кислорода в соответствии с этим определяются следующим образом:
dV
1 = —K(V
1/V)mdt(Уменьшение содержания О
2) + p
1P
1S[V–V
1]dt(Поступление О
2), (5)
Где V первоначальный объем кислорода, м
3, m — масса цветочной продукции внутри контейнера, кг; р — парциальное начальное давление кислорода, Па; К — см. формулу (1).
Решением дифференциального уравнения (5) будет
V
1 = V(1 + mKe
-t/tP
1P
1S)(1+mK/p
1P
1S). (6) В выражении (6) τ—постоянная времени, характеризующая скорость установления стационарного режима:
τ = V/(p
1P
1S + mK). (7)
Если p
1 = 0, то через время t = τ содержание кислорода в контейнере уменьшится в е раз, а через t=4τ упадет ниже предельно допустимого значения—2 %. Это справедливо для замкнутого герметичного объема в отсутствие мембраны, поскольку ее наличие обеспечивает возможность поступления определенного количества кислорода извне.
При дыхании продукции, заложенной на хранение, выделяется количество углекислого газа, пропорциональное объему поглощаемого кислорода (с поправкой на дыхательный коэффициент 6). Количество углекислого газа, проходящего через мембрану dV
2, пропорционально площади мембраны S, парциальному давлению углекислого газа в контейнере (давлением углекислого газа во внешней среде вследствие его малости можно пренебречь), а также проницаемости мембраны по углекислому газу σР
1. С учетом этого для баланса по углекислому газу получим
dV
2 = δ(V
1/V)mKdt-p
1{V
2/V)δP
1Sdt. (8)
Решение уравнений (5) и (8) можно представить в следующем виде (Стрельцов, 1983):
ξ
1 — ξ
0(1+mK/pP
0S); (9)
ξ
2 = δξ
0(σ + p
1P
2S/mK) = δ(ξ
0 — ξ
1)/δ, (10)
где ξ
1 концентрация кислорода; ξ
2 — концентрация углекислого газа; ξ
0 — начальная концентрация кислорода (21 %); δ — селективность.
Рассмотрим некоторые частные случаи, характеризующиеся выражениями (6), (7), (9) и (10).
1. Начало закладки продукции на хранение соответствует значению t = 0. Очевидно, что концентрации кислорода и углекислого газа в контейнере находятся на уровне концентраций в окружающей среде.
2. Мембрана с дефектом (разрыв, перфорация и т. п.). Внутреннее пространство контейнера сообщается с внешней средой. Этому соответствует Р → ∞ при времени выхода на стационарный режим f → ∞, и выражение t>3τ соответствует ситуации, при которой концентрации кислорода и углекислого газа в контейнере совпадают с их концентрациями в окружающей среде.
3. Условиям сохранения герметичности контейнера с продукцией, снабженного ГСЭМТ, при достаточно большом времени с момента закладки на хранение (t>3τ) соответствуют уравнения (9) и (10), которые справедливы для стационарного режима хранения.
На практике при известных характеристиках мембраны (проницаемости, селективности и площади), а также параметрах дыхания закладываемой на хранение продукции и ее массе, воспользовавшись уравнениями (9) и (10), можно определить режим хранения, обеспечиваемый той или иной мембраной. Обычно соотношение концентраций кислорода и углекислого газа для определенной продукции известно хотя бы по типу газовой смеси (нормальная, субнормальная и т. п.). Выражения (9) и (10) помогают рассчитать контейнеры с мембранами для хранения растительной продукции, что в значительной степени сокращает время на проведение поисковых экспериментов.
Для упрощения расчетных соотношений введем параметр «загрузки мембраны»: μ=m/S (кг/м
2). Тогда с учетом (9)
μ = [(ξ
0/μ
0)-1]P
1P
1/K. (11)
Следует отметить, что с помощью одной мембраны невозможна независимая регулировка концентраций кислорода и углекислого газа: если задана концентрация кислорода в стационарном режиме, то концентрация углекислого газа тем самым уже определена уравнением (10).
Представляет практический интерес рассмотрение вопросов возможности регулирования газового состава в контейнерах с ГСЭМТ при хранении цветочной продукции. Известно, что существуют экстремальные значения концентрации кислорода и углекислого газа, превышение которых в случае максимума или снижение ниже минимума недопустимо по биохимическим соображениям. Для кислорода такое экстремальное значение—2, для углекислого газа—10 %. С учетом этого можно определить границы координатной сетки режимов хранения растительной продукции, а также оценить возможности регулирования газового состава в пределах указанных границ при использовании для хранения контейнеров с ГСЭМТ (Корнилова, 1983).
Если отложить по координатным осям значения концентраций углекислого газа и кислорода, то нанесенные на плоскость с такими координатами точки и области возможных режимов хранения образуют четко выраженную тенденцию к группируемости в определенных зонах.
На рисунке 14 показаны возможности перемещения рабочей точки на карте режимов, определяемые координатами ξ
1 и ξ
2, в зависимости от относительной загрузки мембраны μ/μ
0, причем σ — р
1P
1/K(кг/м
2).

Рис. 14. Влияние разброса параметров мембран на координаты области рабочего режима
Загрузка мембраны по желанию может варьировать в определенных пределах. Подбор оптимальных координат концентраций кислорода и углекислого газа можно осуществлять, изменяя относительную загрузку мембраны (соотношение μ/μ
0, путем перемещения вдоль линии σ = const см. рис. 13). В зависимости от относительной загрузки меняется концентрация кислорода и связанная с ней концентрация углекислого газа (табл. 13).

13. Состав газовой среды (%) в зависимости от относительной загрузки мембраны
На практике значение относительной загрузки обычно не превышает 10, будучи ограниченным предельно допустимой концентрацией кислорода, равной 2 %.
В настоящее время разработаны мембраны для хранения свежей растительной, в том числе и цветочной, продукции в МГС типа СИГМА, ПВТМС, МДО-АС и МД-К2, Карбосил-АС. Первая представляет собой текстильную основу, покрытую силиконовым эластомером, например вулканизатом полидиметилсилоксанового каучука. Остальные не имеют тканевой основы. Мембрана ПВТМС изготавливается из поливинилтриметилсилана, а мембраны типа МДО-АС и МД-К2—на основе крем-нийорганических полимеров. Основные характеристики мембран для создания МГС при хранении свежей растительной продукции приведены в таблице 14.

14. Параметры мембран для хранения растительной продукции
Мембраны часто имеют определенный разброс своих параметров, поэтому вместо рабочей точки на карте режимов в координатах концентраций С0
2 и О
2 существует некоторая вероятная рабочая область, размеры которой можно оценить расчетным путем.
Некоторые мембраны имеют коэффициент вариации CV по проницаемости около 40, а по селективности — 25 %. Для оценки величины вероятной рабочей области на карте режимов (средняя селективность а = 3,69 при CV = 25 % и СV = 40 % по проницаемости для кислорода) определим сектор рабочих режимов, задаваемый вариациями селективности а = (3,69+0,25)3,69=3,69=1=0,92, то есть значение селективности будет находиться между вероятными значениями σ
max = 2,77 и σ
mах = 4,61. С учетом того что μ — пропорционально величине Р, коэффициент вариации значения р будет соответствовать коэффициенту вариации для Р. В этом случае при среднем значении μ/μ
0 = 6 возможны отклонения (μ/μ
0)
min = 6—(6•0,4) = 4,6 И (μ/μ
0)
mах = 6+(6–0,4) = 8,4.
Этими координатами и ограничивается площадь возможных режимов, где должна находиться вероятная рабочая точка, соответствующая данной мембране (см. рис. 14, заштрихованная область).
Однако даже в случае совершенно бездефектных мембран создание режима с заданной концентрацией кислорода ξ
1 и углекислого газа 1,2 возможно отнюдь не во всех случаях.
Если имеется набор мембран с различной селективностью а, то газовый состав в упаковке, рассчитанной на определенную массу цветов, можно регулировать двумя путями: изменением площади мембраны S и выбором мембран с разной селективностью σ. Если приходится ограничиваться мембраной одного заданного типа, что часто бывает на практике, то единственной возможностью регулирования газового состава остается изменение площади мембраны, то есть изменение ее загрузки (количества продукции на единицу площади мембраны).
Изменяя загрузку мембраны (соотношение μ/μ
0), можно перемещать рабочую точку вдоль линии σ = const. В зависимости от относительной загрузки меняются концентрация кислорода и связанная с ней концентрация углекислого газа, причем, как было указано выше, последняя не может быть установлена независимо от концентрации кислорода для данной мембраны с заданными свойствами. Вследствие этого приходится ограничиваться таким режимом хранения, который по своим параметрам лишь приближается к оптимальному, и, кроме того, может возникнуть дополнительная погрешность из-за неровности мембран.
Практика хранения цветочной продукции в полимерных упаковках с газоселективными мембранами показывает, что создаваемый режим по газовым компонентам нередко отличается от расчетного, что обусловливает необходимость определенной корректировки. Если для регулирования газовых компонентов использовать по крайней мере две разнотипные мембраны, то возможности корректировки режима МГС существенно расширятся.
При обозначении площадей мембран S
1 и S
2, значений их селективности σ
1 и σ
2 и проницаемости по кислороду P
1 и Р
2 уравнения баланса по кислороду и углекислому газу, аналогичные (5) и (8), можно записать в виде
dV
1 = — K(V
1/V)mdt+pP
1S
1[1-(V
1/V)]dt+pP
2S
2[1 — (V
1/V]dt; (12)
dV
2 = σ(V
1/V)mKdt — pPσ
1S
1(V
2/V)dt — pP
2σ
2S
2(V
2/V)dt. (13)
Решения этих уравнений в обозначениях концентрации будут иметь вид
ξ
1 — ξ
0/[1 + 1/(μ
01/μ
1 + μ
1 + μ
02/μ
2)]; (14)
ξ
2 = σξ
1/[σ
1 — (μ
01/μ
1) + σ
2(μ
02/μ
2)]. (15)
Здесь приняты следующие обозначения:
μ
0i=pP
i/K; μ
i=m/S
i. (16)
С помощью соотношений (14–16) можно рассчитать площади мембран S
1 и S
2 для любого значения режима, задаваемого концентрациями ξ
1 и ξ
2. Получающиеся площади будут иметь неотрицательные значения для любой точки (ξ
1; ξ
2), лежащей внутри сектора, ограниченного прямыми σ
1 = const и σ
2= const. На рисунке 13 видно, что практически вся область хранения как срезки, так и вегетативных органов и семян цветочно-декоративных культур лежит ниже линии σ=1, поэтому материал с такой селективностью целесообразно использовать в качестве одной из мембран. Селективность, равную единице, то есть проницаемость, одинаковую как по кислороду, так и по углекислому газу, имеют любые пористые вещества, например бумага, ткани, нетканевые материалы.
В качестве другой мембраны, с большим значением селективности, целесообразно использовать мембрану, например, типа МДО = АС (а = 4,5). В этом случае диапазон режимов будет достаточно широк, его границы находятся между прямыми σ=4,5 и σ=1 (см. рис. 13).
Таким образом, применение двух разнотипных мембран лучше обеспечивает заданный режим хранения и, следовательно, более высокое качество цветочной продукции в конце периода хранения.
В практике применения контейнеров и упаковок с ГСЭМТ рекомендуется для предохранения газоселективной мембраны от механических повреждений использовать ограждающую прокладку с перфорацией, фиксируемую по периметру мембраны. В результате этого рабочая площадь мембраны уменьшается на величину коэффициента перфорации ограждающей прокладки. Коэффициент перфорации учитывает частичное перекрытие рабочей площади мембраны материалом прокладки. Это обстоятельство необходимо иметь в виду при практических расчетах контейнеров и упаковок.
Пусть радиус отверстий перфорации будет R, расстояние между центрами отверстий Н, тогда коэффициент перфорации определится соотношением
φ=πR
2/H
2=π(R/H)
2.
Очевидно, что полезная площадь мембраны 5М уменьшится пропорционально коэффициенту перфорации:
Максимально возможное значение коэффициента перфорации при H = R будет π/4≈0,785.
ТЕХНОЛОГИЯ ХРАНЕНИЯ ЦВЕТОЧНОЙ ПРОДУКЦИИ В МОДИФИЦИРОВАННОЙ ГАЗОВОЙ СРЕДЕ
Для расчета упаковок и контейнеров с ГСЭМТ можно пользоваться соотношениями (9—11). Задавая концентрацию кислорода в упаковке с продукцией, с помощью этих выражений рассчитывают необходимую площадь газоселективной мембраны и ожидаемую концентрацию углекислого газа в упаковке с ГСЭМТ.
Рассмотрим возможность расчета контейнеров с ГСЭМТ для хранения в МГС срезанных цветов и стеблевых черенков на примере гвоздики ремонтантной. В результате предварительных экспериментов (Стрельцов, 1982) было установлено, что срезанные цветы и стеблевые черенки хорошо сохраняются в МГС при содержании кислорода около 12–18 %. Определение параметров дыхания срезанных цветов и стеблевых черенков гвоздики показало, что для них характерны значения начальной интенсивности дыхания К
0 3,3410
-8 и 1,74•10
-8 м
3/с•кг соответственно, а дыхательного коэффициента σ 1,3.
Воспользовавшись выражением (10), можно определить оптимальное для этого случая содержание углекислого газа в МГС при ГСЭМТ, например, из поливинилтриметилсилана (ПВТМС) с селективностью σ=3. Подставив в формулу (10) известные значения, получим для углекислого газа значения концентрации от 1,3 до 4 %. С учетом того что проницаемость мембраны ПВТМС по кислороду P
1 = 5-10-10 м
3/с, на основе выражения (11) для загрузки мембраны в случае хранения цветочной срезки получим значения μ≈200, а стеблевых черенков μ≈450 кг/м.
Практически при длительном хранении срезанных цветов и стеблевых черенков гвоздики ремонтантной в мягких полиэтиленовых пленочных контейнерах-упаковках с ГСЭМТ площадью 4 см
2 до 10 цветов (80—100 г) или 200 г черенков в каждом контейнере в условиях стационарного режима устанавливался следующий состав МГС. Для цветов содержание углекислого газа составляло 1–5, кислорода 14–18 %, для черенков 2–5 и 12–15 % соответственно, что согласуется с расчетными данными.
Цветочная срезка гвоздики в таких условиях сохраняет свои качественные показатели при температуре хранения 3–6 °C в течение 10–12 недель, а стеблевые черенки — 16–20 недель. Причем снятые с хранения и поставленные в воду в комнатных условиях цветы полностью распускаются через 3–4 дня, а черенки сохраняют тур-гор и свежесть, имеют каллюс и частично корневые зачатки, хорошо укореняются и развиваются. При хранении в тех же температурных условиях в холодильной камере (контроль) цветы и черенки теряли товарное качество на третью и пятую неделю соответственно.
Рассмотренный способ хранения цветов и черенков в малогабаритных полимерных пакетах с ГСЭМТ наиболее приемлем для цветоводческих хозяйств с небольшим объемом производства цветочной срезки и черенков.
Технология хранения цветов и черенков в модифицированной газовой среде с ГСЭМТ предусматривает срезку, например гвоздики первого сорта и экстра в полуроспуске без следов обработки химическими препаратами, без капельной влаги и механических повреждений. В прохладном помещении (6—10 °C) формируют букеты по 10–20 цветов. Лучшие результаты дает последующая упаковка букетов цветов в полимерную рукавную сетку (см. главу 2).
Перед закладкой цветов в пленочную упаковку с ГСЭМТ тщательно проверяют целостность материала упаковки и мембраны, а также мест сопряжения ее с упаковкой. При обнаружении проколов и небольших порезов упаковки их герметизируют полимерной липкой лентой, а нарушенную целостность швов упаковки устраняют термосвариванием.
Затем цветы, количество которых зависит от параметров мембраны, помещают в упаковку стеблями вниз и выдерживают в течение 2–3 ч пакеты с открытой горловиной в условиях холода (при 1–4 °C) во избежание образования конденсата, после чего герметизируют и устанавливают в вертикальном положении в коробчатую тару или в ящики на хранение, следя за тем, чтобы площадь ГСЭМТ не перекрывалась соседними упаковками. При герметизации упаковок термосваркой рекомендуется проводить ее в условиях прохладного помещения с последующим переносом цветов в хранилище и постепенным понижением температуры до рекомендуемых пределов. Герметизацию механическим способом проводят с помощью профильного полиэтиленового замка или путем сбора горловины упаковки в жгут с последующим его перегибом в продольном направлении и перевязкой.
Хранение цветов проводят на стеллажах в холодильных камерах. К упаковкам с цветами должен быть обеспечен доступ, так как их необходимо систематически осматривать (2 раза в неделю) и отбирать пробы газового состава (не реже одного раза в месяц). Для анализа газового состава проб, отбираемых из упаковок с хранимой продукцией, рекомендуется применять переносные газоанализаторы типа ГХП-ЗМ и ВТИ-2 (см. главу 8).
При обнаружении видимого ухудшения качества цветов, а также сильного отклонения режима хранения по газовому составу (углекислого газа более 10, кислорода около 2 %) в какой-либо упаковке ее снимают с хранения. В результате товароведной экспертизы устанавливают причины нарушения режима хранения и снижения качества продукции, после чего стандартные цветы отправляют в реализацию, а утратившие товарный вид списывают.
Сроки хранения увеличиваются на 5—10 дней при добавлении в упаковку с цветами активированного угля (одна таблетка на 20–30 цветов), который способствует поглощению этилена и снижению избыточной влажности.
Снятие цветов с хранения для реализации проводят в обратном порядке. Разгерметизированные цветы выдерживают 2–3 ч в упаковках с открытой горловиной, затем переносят в сортировочное помещение с температурой 10–15 °C, где после осмотра и отбраковки упаковывают и отправляют в реализацию. Один из вариантов технологии хранения срезанных цветов в МГС представлен на рисунке 15.

Рис. 15. Схема хранения срезанных цветов с применением контейнеров с ГСЭМТ: 1 — срезка цветов; 2 — предварительное охлаждение; 3 — упаковка в мягкий контейнер с ГСЭМТ и коробчатую тару; 4 — хранение в холодильной камере
Технология хранения стеблевых черенков гвоздики ремонтантной в МГС близка к технологии хранения цветов. Она предусматривает заготовку черенков в зрелом состоянии, здоровых, без следов повреждений и поражения микрофлорой, чистых и без следов капельной влаги. Свежезаготовленные черенки переносят в сортировочно-упаковочное помещение с температурой 10–15 °C, где затаривают в полимерные пленочные упаковки с ГСЭМТ. Количество черенков в каждой упаковке зависит от ее параметров, а также параметров мембраны. Следует отметить, что как для цветов, так и для черенков эффективность хранения в МГС тем выше, чем меньше период времени между срезкой и размещением на хранение. Черенки помещают в упаковки основанием стеблей вниз и переносят в холодильную камеру на 2–3 ч в пакетах с открытой горловиной. Порядок герметизации, хранения, контроля качества, а также снятия с хранения такой же, как и для срезанных цветов. Введение в упаковку с черенками перед ее герметизацией 1–2 таблеток активированного угля на 0,5–1 кг черенков позволяет увеличить срок хранения на 1–2 недели. Лучшие результаты получают при хранении с температурным режимом 1–4 °C.
При хранении цветов и черенков в упаковках с ГСЭМТ следует обратить особое внимание на стабильность температуры в камерах хранения. Ее суточные колебания не должны быть более ±1 °C. В противном случае, особенно при резком скачке температуры, неизбежно появление в упаковках с продукцией конденсата, который способствует спонтанному развитию микрофлоры (обычно плесени). Хранение цветов и черенков в МГС с использованием пленочных упаковок с ГСЭМТ можно проводить и в бытовых холодильниках. При этом если не всю партию цветов одновременно снимают с хранения, то для поддержания температуры на постоянном уровне в месте помещения упаковок с продукцией следует предусмотреть термоизоляцию (лист полипропилена или аналогичного материала) со стороны открываемой двери холодильника.
Кроме того, на уровне полки с заложенной на хранение продукцией необходимо установить или положить термометр. Возможно хранение цветочной продукции в упаковках с ГСЭМТ при более высоких (до 11 °C) температурах, однако и в этом случае резких колебаний не должно быть, максимальный же срок хранения при таких температурах заметно сокращается.
Более экономично и результативно для цветоводческих хозяйств хранение цветов и черенков в укрупненных мягких контейнерах в виде отдельных мешков (мягких контейнеров) или полиэтиленовых накидок с ГСЭМТ. Подобный способ хранения значительно сокращает затраты материалов на единицу массы продукции, снижает трудоемкость и эксплуатационные расходы.
Технология хранения цветов и черенков в укрупненных упаковках близка к методу хранения в малогабаритных пленочных упаковках с ГСЭМТ. Срезанные цветы и черенки одного вида и сорта закладывают без сдавливания в полимерные ящики или короба. Перед закладкой продукции ящики следует обработать дезинфицирующим раствором с последующим ополаскиванием чистой водой. Стеблевые черенки (1000 и более) в зависимости от габаритов тары и параметров контейнера с ГСЭМТ ставят вертикально в ящики срезом вниз (рис. 16). После этого ящики с черенками в прохладном помещении затаривают в полимерный или пленочный контейнер так, чтобы мембрана располагалась над черенками, и переносят в хранилища, где выдерживают с открытой горловиной для температурной адаптации 2–3 ч. Затем горловину контейнера герметизируют.

Рис. 16. Ящик с черенками
Сформированные в букеты цветы ставят вертикально в глубокий ящик из полимерного материала срезами вниз. При отсутствии специальной глубокой тары цветы можно размещать горизонтально в стандартных ящиках и коробках с водоотталкивающим покрытием. Однако при этом перед закладкой цветов следует на дно тары положить решетчатую прокладку во избежание прямого контакта цветов с капельным конденсатом, который в некоторых случаях может образовываться на дне ящика. Ящики с цветами размещают в мягких контейнерах с ГСЭМТ.
Хранение, контроль качества, снятие с хранения для реализации цветов и черенков в крупномерных контейнерах-упаковках проводят аналогично хранению в малогабаритных пленочных упаковках. В единичную укрупненную упаковку можно размещать не один, а группу ящиков или штабель с цветами и черенками, тогда укрупненной упаковкой служит полимерная пленочная накидка, герметизируемая у пола тем или иным способом: присыпкой закраин валиком песка, погружением в канавку с водой по периметру штабеля, свариванием с подложенным под штабель листом полиэтилена и т. д. При соблюдении технологии закладки на хранение, поддержании стабильного температурного режима (1–4 °C) черенки в ящиках, помещаемые в мягкие пленочные контейнеры с ГСЭМТ, хранятся до 25–26, а цветы гвоздики — 13–14 недель.
Закладка и хранение цветов и черенков в единичную укрупненную упаковку-контейнер без дополнительных мероприятий по сохранности продукции может привести к частичной порче ее из-за продолжительного времени перехода к режиму хранения (от нескольких дней до нескольких недель в зависимости от массы продукции в контейнере).
Для устранения этих недостатков необходимо ускорять вытеснение избыточного кислорода из загруженного продукцией объема при одновременном увеличении в нем концентрации углекислого газа и улучшении режима охлаждения.
Эту универсальную задачу можно решить следующим образом. Перед герметизацией в нижнюю часть контейнера или под накидку с цветами и черенками помещают твердую углекислоту «сухой лед» (Рукавишников, 1982). Сухой лед, обладая способностью сублимироваться при температуре — 78,9 °C, не только вытесняет из контейнера избыток кислорода, но и обеспечивает увеличение концентрации углекислого газа, а также предварительное охлаждение заложенной на хранение продукции, поглощая 640 кДж/кг теплоты, что соответствует двукратной холодопроизводительности водного льда. В результате резко ускоряется достижение стационарного режима хранения и сводится до минимума вероятность появления на цветах и черенках конденсата. При сублимации твердой углекислоты отсутствует влага, вызывающая коррозию конструктивных материалов и ухудшающая прочность клеевых соединений. Кроме того, твердая углекислота нейтральна к металлам, а ее газовая атмосфера обладает бактерицидным действием.
Для определения необходимого количества твердой углекислоты нужно знать объем выделяющегося углекислого газа (Тезиков, 1952)
V = RT/P — A
где V — объем углекислого газа, выделившегося из 1 кг твердой углекислоты, м
3/кг; R — газовая постоянная, равная для углекислого газа 19,7 кгсм/кг•К°; Т — абсолютная температура, °К; Р — давление, кг/м
2; А — дополнительный член, характеризующий отклонение от уравнения состояния идеального газа.
При комнатной или пониженной положительной температуре (6—10 °C), которая обычно бывает при закладке продукции на хранение, и нормальном атмосферном давлении значением дополнительного члена А можно пренебречь вследствие его малости. Тогда при 20 °C и давлении 101,3 кПа объем выделяющегося углекислого газа равен 0,55 м
3/кг, а для условий охлаждаемого помещения (1–6 °C; 101,3 кПа) — 0,5 м
3/кг.
Большое значение при обеспечении режима хранения с помощью твердой углекислоты имеет также скорость достижения оптимальной для хранения концентрации углекислого газа. Она определяется скоростью сублимации твердой углекислоты и для нормальных условий близка к 610
-6 кг/с, а для охлаждаемого помещения составляет 1,5•10
-6 кг/с. Расчеты показывают, что для создания оптимальной МГС при содержании СО
2 1–5 % и О
2 12–18 % на 1 кг цветочной продукции достаточно около 0,5 г твердой углекислоты. С учетом потерь на сублимацию в окружающее пространство при укрытии и герметизации продукции, а также в зависимости от вида и сорта ее реальное значение расхода твердой углекислоты может доходить до 1 г на 1 кг цветочного материала.
Применение твердой углекислоты позволяет сократить достижение режима хранения по газовому составу до 3–5 ч вместо нескольких дней при традиционном способе создания МГС. Одновременно с этим срок хранения цветочной продукции увеличивается на 2–3 недели. Следует отметить, что кратковременное превышение (ударная обработка) оптимального состава МГС по углекислому газу (свыше 10 %) благотворно сказывается на результатах хранения цветочной продукции.
Стабильность газового состава в крупномерном пленочном контейнере-накидке с заложенной на хранение продукцией зависит от герметичности получаемой емкости. В этом отношении решающую роль играет проницаемость ограждающих конструкций и в особенности закраины пленки внизу штабеля. Для оценки степени герметичности внутри емкости создают избыточное давление и определяют скорость его падения. При этом газоселективные мембраны, вмонтированные в боковые стенки накидки, необходимо «заглушить».
При недостаточной герметизации емкости газовая среда, образующаяся в процессе дыхания цветов и черенков и диффузии газовых компонентов сквозь газоселективную мембрану, будет существенно отличаться от расчетной, особенно если из-за перепада давления внутри емкости по отношению к наружной среде конвекционный газообмен будет превышать диффузионный.
При начальном перепаде давлений между внутренним объемом емкости и наружной атмосферой, равном р
0, зависимость перепада давлений р от времени t определяется соотношением (Метлицкий, 1972)
p(t) — р
0е
-λt = р
0е
-λt=p
0e
-t/t0, (18)
где λ — коэффициент падения давления, с
-1; t
0 — постоянная времени, с.
Емкость для хранения обладает достаточной степенью герметичности, если перепад давления снижается с 245 до 25,5 кПа. Пользуясь соотношением (18), получим выражение для λ в виде
λ = [ln(p
0/p(t))]
При подстановке в формулу (19) указанных значений получим λ = 1,510
-3 с
-1, чему соответствует постоянная времени t
0 = 666 с.
Реальные данные, характеризующие требования к герметичности камер холодильного хранения, отличаются от приведенных выше величин в сторону больших допусков на негерметичность. В частности, для субнормального и нормального газового режимов хранения они имеют следующие значения: нормальный режим λ
1 = 0,1 с
-1, субнормальный режим λ
2 = 0,04 с
-1.
Экспериментально установлено, что при герметизации штабеля с цветочной продукцией под накидкой с газоселективной мембраной (с присыпкой закраины у пола песчаным валиком) коэффициент падения давления λ при t
0 = 1200 с в случае применения сухого песка составляет 1,3310
-3 с
-1, а увлажненного (влажность= 13,6 %) — 7,25•10
-4 с
-1. Эти значения соответствуют требованиям, которые предъявляются к степени герметизации емкости для хранения.
Хранение цветочной продукции в укрупненных упаковках — мягких контейнерах и под накидками с ГСЭМТ с использованием твердой углекислоты для ускорения перехода к режиму хранения и предварительного охлаждения позволяет сохранять срезанные цветы гвоздики в течение 14–16, а стеблевые черенки — до 29 недель.
Максимального срока хранения срезанных цветов и стеблевых черенков гвоздики — 20–22 и 30–34 недели соответственно — достигают при использовании МГС в сочетании с твердой углекислотой с условием предварительной выдержки цветочной продукции в водной среде, насыщенной озоном (см. главу 3).
Результаты наблюдений за состоянием продукции в процессе хранения следует заносить в журнал учета. Рекомендуемая форма регистрации наблюдений приведена ниже.

Результаты хранения цветов (черенков)
Все виды упаковок с ГСЭМТ можно использовать повторно. Для этого необходимо изнутри тщательно протереть или ополоснуть упаковку дезинфицирующим раствором с последующей ее просушкой и контролем целостности перед очередной закладкой цветочной продукции.
ГЛАВА 5. ХРАНЕНИЕ СЕМЯН ЦВЕТОЧНЫХ КУЛЬТУР ОСОБЕННОСТИ МОРФОЛОГИИ И ФИЗИОЛОГИИ СЕМЯН
Большинство садовых цветов, обычно размножаемых семенами, относится к однолетним двудольным растениям. Благодаря направленной селекции их семена после периода покоя, приходящегося на хранение, отличаются достаточно высокой всхожестью и развиваются нормально.
По морфологическим структурам (рис. 17) семена цветочно-декоративных растений подразделяются на восемь групп и два класса (Atwater, 1980):

Рис. 17. Морфологические особенности семян цветочно-декоративных растений: 1 — оболочка; 2 — эндосперм; 3 — ядро. Остальные обозначения в тексте
I. Семена с преобладанием эндосперма и неразвитым зародышем.
А — базальный рудиментарный зародыш;
В — зародыш с осевым строением;
С — миниатюрный зародыш с осевым строением;
D — линейный нецентральный зародыш.
II. Семена без эндосперма или с остаточным эндоспермом и развитым зародышем
А — твердая семенная оболочка, затрудняющая влагонабухание;
В — тонкая семенная оболочка со слизистым слоем;
С — одревесневшая семенная оболочка с внутренним полупроницаемым слоем;
D — волокнистая семенная оболочка с отдельным полупроницаемым слоем.
Периоды покоя (хранения) и прорастания в каждой из этих восьми групп имеют много общего, чем определяется выбор соответствующей технологии хранения и выращивания.
Для семян с базальным рудиментарным зародышем (IA) характерно базальное расположение последнего в окружении эндосперма, занимающего почти все внутреннее пространство семени. Семядоли едва различимы и состоят лишь из небольшого числа клеток. Семенная оболочка рыхлая, волокнистая, легкопроницаемая. Семена варьируют по размерам. Основная проблема инициации развития в период времени после снятия с хранения заключается в недостаточной зрелости зародыша, что усугубляется наличием ингибиторов роста в эндосперме. Значительно улучшает всхожесть предварительная стратификация или обработка семян гиббереллином. К этой группе декоративных растений относятся анемона, аквилегия (водосбор), дельфиниум (шпорник), нигелла, различные виды мака, эшшольция, дицентра (разбитое сердце), ряд цветочных культур из семейства аралиевых.
Семена группы IB характеризуются центральным положением зародыша, имеющего осевое строение. Семядоли тонкие, короткие. Эндосперм занимает половину или более объема семени, окружая зародыш. Семенная оболочка тонкая, рыхлая, волокнистая, полупроницаемая. Размер семян варьирует от 3 до 10 мм. Физиологически семена этой группы похожи на семена группы IA, но отличаются от них большим размером и развитием зародыша. Для семян группы характерен большой разброс по времени зрелости. Для улучшения всхожести после хранения целесообразно проращивание на свету, обработка гиббереллином. В группу входят рододендрон, примула (первоцвет), цикламен, горечавка, физалис.
Семена группы IС имеют центрально расположенный зародыш осевого строения, лопатообразной формы. Эндосперм занимает половину или менее внутреннего пространства и окружает семя. Семенная оболочка тонкая и хрупкая, семена отличаются малыми размерами (1 мм и менее). Характерна хорошая всхожесть. Семена чувствительны к интенсивности и продолжительности светового облучения. При обработке гиббереллином энергия прорастания семян улучшается. К этой группе относятся очиток, зверобой, табак душистый, петуния, сальпиглоссис, львиный зев, наперстянка, губастик, немезия, лобелия.
У семян группы ID зародыш занимает периферийную позицию в окружении перисперма и эндосперма. Семядоли тонкие и узкие. Семенная оболочка покрыта тонкой кожицей с остатками чашелистиков. Семена сильно варьируют по размерам. Многие из них прорастают быстро, но значительная часть теряет всхожесть после хранения. Удаление внешнего покрова способствует прорастанию. Декоративные растения этой группы следующие: горец, кохия, амарант, целозия, гомфрена, портулак, гвоздика, гипсофила, лихнис (горицвет), сапонария (мыльнянка).
Общее для групп IIА — IID — полное отсутствие эндосперма или сравнительно слабое его развитие. Семена этих групп имеют развитые зародыши, вполне подготовленные к проращиванию.
В группу IIА входят семена, имеющие твердую оболочку, затрудняющую увлажнение. Зародыш занимает большую часть объема семян, форма его извитая, лопатообразная. Семядоли большие, хорошо развитые. Эндосперма или нет вообще, или он представляет собой тонкий слой, выстилающий семенную оболочку изнутри. Оболочка твердая, увлажняется с трудом. Размеры семян от 2 до 15 мм. При подсыхании оболочка становится непроницаемой, особенно после хранения сухим способом. Проницаемость ее увеличивается при воздействии различных физических и химических факторов, старении и в случае поражения некоторыми видами грибов. К наиболее распространенным способам размягчения семенной оболочки при подготовке семян к посеву относятся обработка их серной кислотой или этиловым спиртом, повышенным давлением, скарификация, ударное воздействие, замораживание или воздействие повышенными температурами. Некоторые из семян этой группы выдерживают нагревание до 30 °C, но прорастают лишь при снижении температуры до 20 °C и ниже. К числу растений этой группы относятся лобелия, лотос, люпин, пеларгония (герань), мальва, вьюнок, ипомея.
Семена группы IIВ отличаются тонкой семенной оболочкой со слизистым слоем. Зародыш занимает большую часть внутреннего пространства, имеет лопатообразную форму. Эндосперм редуцирован до тонкого слоя вокруг зародыша. Семена небольшого размера (1–5 мм). Слизистая прослойка семян при набухании становится менее проницаемой для кислорода и других газов. Эти семена хорошо отзываются на воздействие гиббереллином, светом, калиевой селитрой. Благотворное влияние оказывают повторяющиеся резкие перепады температур. К указанной группе принадлежат резуха (арабис), иберис, левкой, декоративный лен, фиалка, лаванда.
Группа IIС включает растения, лопатообразный зародыш которых занимает большую часть семени. Семядоли большие. Эндосперм отсутствует или имеется в виде тонкого слоя, выстилающего семенную оболочку. Семена среднего размера (от 2 до 8 мм). Большинство их представляет собой семянки или орешки, достаточно проницаемые для воды, но непроницаемые для газов и некоторых химических веществ. Выщепленные зародыши прорастают в течение 48–70 ч. Все эти семена характеризуются толстой оболочкой, частичное удаление или расщепление которой значительно улучшает всхожесть, особенно если сочетается с воздействием гиббереллином. Растения, семена которых относятся к этой группе, украшают наши сады и цветники. Это розоцветные, бальзамин, солнцецвет, кларкия, флокс Друммонда, флокс метельчатый, немофила, гелиотроп, незабудка, вербена, колеус, скабиоза.
Группу IID составляют растения, семена которых имеют отдельный полупроницаемый мембранный слой. Зародыш занимает большую часть семени, имеет лопатообразную форму. Семядоли большие, эндосперм редуцирован до прослойки толщиной в 1–2 клетки, выстилающую плотную мембрану, которая обволакивает зародыш. Семянку покрывает волокнистая оболочка лучеобразной или дисковой формы, хорошо приспособленная для рассеивания семян. Размеры семян варьируют от 1 до 10 мм. Прорастанию препятствует внутренняя мембранная прослойка, окружающая зародыш. Ингибиторы, сосредоточенные в семядолях, не выщелачиваются до тех пор, пока, мембрана не станет проницаемой. Резкие температурные перепады, промывка помогают преодолеть такую блокировку. В группу входят растения одного семейства — сложноцветных, к которому относятся многие из распространенных садовых цветов: тысячелистник, долгоцветка, маргаритка, ноготки, астра, хризантема, ленок, георгина, диморфотека, гайлардия, ромашка, рудбекия, бархатцы, цинния.
Морфологически подобные группы семян декоративных растений имеют сходный характер прохождения периодов покоя и прорастания. Блокируют прорастание и поддерживают состояние покоя в основном морфологические факторы, а роль стимулятора прорастания выполняют факторы внешней среды. Соотношениями между этими двумя группами факторов определяются различные пути управления прорастанием, и организм может реагировать на различные комбинации влажности, температуры, света, химических и физических воздействий в рамках морфологической структуры. Малая проницаемость оболочки семян по кислороду может вызвать задержку прорастания. В процессе прорастания сильно возрастает интенсивность дыхания, поскольку на самых первых этапах прорастания необходима затрата значительной энергии на мобилизацию запасных веществ семени, которые нужны для питания зародыша. Для этого необходимы соответствующие ферменты, находящиеся в эндосперме или в самом зародыше в связанном, неактивном состоянии. В процессе набухания происходит активация таких ферментов, кроме того, при этом синтезируются новые ферменты, которые катализируют распад белков, переход крахмала в сахара, расщепление жиров. Образовавшиеся растворимые соединения идут на поддержание дыхания или транспортируются в зародыш, где происходит образование новых веществ, необходимых для построения клеток и органов. Процесс прорастания регулируется фитогормонами, под действием которых начинается деление и растяжение клеток зародыша.
Ингибиторы (например,
абсцизовая кислота), имеющиеся в семенах, гарантируют отсутствие метаболической активности последних в период хранения. Прорастанию могут препятствовать ингибиторы, находящиеся в оболочке семян или в оставшихся органах цветка, окружающих семя. Прорастание можно стимулировать выхолаживанием семян в проточной воде, воздействием активатором роста гиббереллином, другими химическими и физическими средствами, специфичными для каждой группы семян. Итак, вслед за прерыванием покоя семена прорастают, а при достаточном тепле, влажности и доступе кислорода скорость метаболизма повышается, растение начинает развиваться.
Обычно период хранения семян цветочно-декоративных растений продолжается от двух месяцев до полугода. Если после снятия с хранения энергия прорастания при испытаниях окажется слишком низкой, семена целесообразно подвергнуть определенной обработке (специфичной для каждой группы семян), чтобы прервать состояние покоя и спровоцировать развитие зародыша.
ОСНОВЫ ХРАНЕНИЯ СЕМЯН
В процессе хранения на качество семян влияет комплекс факторов окружающей среды: влажность, температура, газообмен, состав атмосферы хранилища или упаковки, характер семенных покровов, степень зрелости, микрофлора.
К числу факторов, ограничивающих длительность хранения жизнеспособных семян, прежде всего относятся температура и влажность. Обычно чем ниже температура и меньше содержание влаги в хранилище, тем дольше семена остаются жизнеспособными. Некоторые исследователи считают, что продолжительность хранения удваивается при понижении количества влаги на 1 % или температуры на 5 °C.
При данных температуре и относительной влажности воздуха равновесная влажность семян варьирует в зависимости от вида и сорта растений. Большинство семян при условии, что они не увлажнены, хорошо хранятся при температуре —20 °C. Такое длительное хранение при пониженных и даже отрицательных температурах весьма важно для сбережения генетического фонда цветочно-декоративных растений. Оптимальным является хранение семян при температурах —18 °C и ниже в герметически закрытых контейнерах при влагосодержании, не превышающем 5±1 %.
Один из самых важных факторов — влагосодержание. Это относится не только к абсолютному содержанию влаги, но и к колебаниям средней «критической» влажности, варьирующей в зависимости от типа семян.
Семена различных видов цветов характеризуются различной способностью поглощать влагу, что зависит от их химического состава и морфологии. Устойчивость семян к обезвоживанию связана с толщиной семенных покровов, запасом питательных веществ в семени. К набуханию наименее устойчивы семена, богатые альбумином, более высокую устойчивость имеют семена с высокой масличностью и наибольшей устойчивостью отличаются крахмалистые. Содержание влаги в семенах является одним из решающих факторов. В связи с тем что содержание влаги в семенах во многом определяет их способность к хранению, для подготовки семенного материала к хранению применяют искусственную сушку. Максимальная температура сушки варьирует в зависимости от вида декоративных растений. Семена травянистых культур, по данным Л. Бартон, можно сушить при температурах до 49 °C, семена бобовых и луковичных — до 32 °C. Семена сушат, применяя горячий воздух с принудительной вентиляцией, или помещают их над гигроскопическими веществами, такими как хлористый кальций, окись кальция, селикагель.
Влияние влажности на жизнеспособность семян тесно связано с температурой хранения. Чем выше температура при данной влажности, тем быстрее семена теряют всхожесть, пониженные температуры способствуют долговечности семян. Когда температура хранения ниже точки замерзания воды, обеспечить сохранность семян можно только при отсутствии механических повреждений их тканей, иногда возникающих во время замораживания.
Если количество влаги в семенах не слишком велико, то содержание их в холодных хранилищах (температура 5—10 °C) намного повышает долговечность по сравнению с хранением при комнатных температурах. Однако при слишком большой влажности в хранилище семена при 5 °C портятся быстрее, чем в сухом помещении при температуре 25 °C.
Отрицательные температуры более благоприятны для хранения семян многих видов декоративных растений, чем положительные, причем некоторые семена выносят глубокое охлаждение до температуры жидкого азота (—196 °C) без потери всхожести.
От температуры и влажности окружающей среды зависят интенсивность дыхания и газообмен семян при хранении. Особенное значение приобретает вопрос о газообмене, когда семена хранятся в условиях контролируемой атмосферы (МГС или РГС). Снижение интенсивности дыхания может способствовать повышению долговечности семян. Чтобы уменьшить интенсивность дыхания семян, их хранят при пониженных давлениях. Семенные покровы влияют на газообмен семян, проницаемость их для разных газов может быть неодинаковой, причем газопроницаемость покровов сухих семян минимальна и возрастает с увеличением влажности. Этим обусловлено благоприятное действие сушки для многих семян декоративных растений — из-за селективной проницаемости семенных оболочек внутри семени устанавливается модифицированная атмосфера, то есть семенные оболочки ведут себя подобно мембранам, используемым при хранении в МГС.
Непроницаемая часть семенной оболочки у многих видов растений представляет собой воскообразную кутикулу. Семена этих растений после снятия с хранения обрабатывают серной кислотой, чтобы сделать оболочку более проницаемой для воды.
Механические повреждения семян обычно приводят к потере жизнеспособности при хранении, такие семена легко поражаются микроорганизмами. Развитию микрофлоры на семенах способствуют также высокое влагосодержание и повышение температуры. При этом происходит интенсивное заражение плесневыми грибами, возможны поражение зародыша и резкое снижение всхожести.
Восприимчивость к почвенным патогенным микроорганизмам повышается с возрастом семян, что связано с изменением проницаемости семенных покровов.
На результаты хранения большое влияние оказывает спелость семян, которая определяется сроками уборки и созревания, различными для разных видов растений. Семена, убранные до наступления молочной спелости и во время ее, по всхожести и долговечности уступают семенам, убранным в период восковой и полной спелости. Для хранения целесообразно брать семена, собранные с растений, посеянных в более ранние сроки, так как эти семена содержат меньше влаги.
Семена многих видов цветочно-декоративных растений в обычных условиях хранения при комнатной температуре и соответствующей относительной влажности быстро теряют всхожесть. Поэтому было проведено исследование различных режимов хранения на всхожесть семян: при комнатной температуре, при температуре холодного хранилища (8 °C) и при отрицательной температуре (—15 °C). По данным Л. Бартон, хорошие результаты получены при хранении семян дельфиниума при 8 °C в герметичных сосудах — всхожесть сохранялась в течение 143 месяцев, но наилучший эффект был в случае хранения в герметичных сосудах при температуре — 15 °C.
Хранение семян астры дало несколько иные результаты. Семена хранились при комнатной температуре, при температуре 5 °C и — 4 °C. Влажность устанавливали на трех уровнях в диапазоне от 4 до 8 %. Для того чтобы сохранить семена астры в открытых контейнерах в течение 1,5 года, оказалось необходимым использовать отрицательные температуры. При хранении сухих семян в герметичных контейнерах продолжительность жизни может быть увеличена до 9 (температура 5 °C) и даже до 16 лет (-4 °C).
Воздушно-сухие семена душистого горошка, анютиных глазок хорошо хранятся как при температуре 5 °C, так и — 4 °C: они остаются жизнеспособными при хранении в открытых контейнерах в течение 13, а в герметичных контейнерах — в течение 33 месяцев.
Для количественной характеристики потери всхожести семенами используют понятие «период потери половины всхожести». Этот период соответствует уменьшению всхожести на 50 %. Если построить кривую падения всхожести в зависимости от времени (рис. 18), где по вертикальной оси отложена всхожесть или энергия прорастания в относительных единицах (начальная всхожесть принята за 100 %), по горизонтальной — время (в годах), то, проведя горизонталь, соответствующую 50 % всхожести, можно получить значение полупериода потери всхожести, то есть времени, в течение которого она уменьшается наполовину.

Рис. 18. Изменение всхожести семян в зависимости от времени хранения: 1, 2, 3 — индексы сохраняемости семян
В соответствии с этим семена можно характеризовать так называемым индексом сохраняемости. В случае, когда они теряют половину всхожести в течение 1–2 лет хранения, соответствующий индекс равен 1; если этот срок составляет 3–5 лет, индекс сохраняемости будет 2; более 5 лет — 3.
Значения индекса сохраняемости и другие показатели долговечности семян некоторых цветочно-декоративных растений приведены в таблице 15 (Justice, 1977). На основе данных таблицы можно выделить четыре группы семян.

15. Характеристика долговечности семян цветочно-декоративных растений
1. Семена с малой начальной всхожестью (55 %), которые быстро теряют свои репродуктивные способности (32 % в год).
2. Семена со средней начальной всхожестью (70 %), у которых потери всхожести составляют около 6 % в год.
3. Семена с высокой начальной всхожестью, ежегодные потери всхожести у них около 3,2 %.
4. Семена с малой и непостоянной начальной всхожестью, которые, однако, теряют свои репродуктивные способности весьма медленно (0,85 % в год).
ХРАНЕНИЕ СЕМЯН ПРИ СВЕРХНИЗКИХ ТЕМПЕРАТУРАХ
В последние годы установлено, что сверхнизкие температуры, соответствующие температуре сжижения азота (—196 °C) и воздуха (—253 °C), способствуют практически неограниченному по времени хранению семенного фонда целого ряда растений. При столь низких температурах прекращается биохимическая активность, семена погружаются в состояние глубокого анабиоза. Успешное хранение семян, по данным В. А. Федосеенко, определяется как факторами, зависящими от самих семян, и прежде всего их влажностью, так и скоростью сверхнизкотемпературного охлаждения. Для семян цветочно-декоративных растений оптимальная влажность 5—10 %. Скорость охлаждения варьирует в широких пределах в зависимости от вида растений и может изменяться от 5 до 100 °Cс. При этом возможны повторные глубокие охлаждения семян после расконсервации. Отмечены случаи, когда семена переносили полное самоиспарение жидкого азота или другого низкотемпературного хладагента (жидкого воздуха, кислорода, водорода), если скорость отогрева не превышала одного градуса в минуту.
Допускается увеличение влажности в 1,5–2 раза выше оптимальной, но при этом возможно травмирование семян при охлаждении. Если семена обладают повышенной влажностью, необходимо применять большие скорости охлаждения, использовать специальные пасты с высокой теплопроводностью, чтобы не допускать частичного или полного разрушения семян из-за кристаллизации воды. При небольших повреждениях развиваются аномальные проростки с патологией семядолей, точки роста, корневой системы.
Для сверхнизкотемпературного хранения семян применяют упаковочные материалы типа хлопчатобумажной марли или сетки и термостойких полимеров: полипропилена, полистирола, капрона. Выбор типа материала и размеров ячей зависит от морфологических особенностей, влажности и биохимического состава семян. Для крупных семян лучше использовать сетки с большими размерами ячей. Если семена обладают повышенной влажностью, предпочтительнее тара в виде мешочков из марли или крупноячеистой сетки, что позволяет избежать кристаллизации воды. Этой же цели служат и некоторые криопротекторы. Посевные качества семян после сверхнизкотемпературного хранения улучшаются. После трехлетнего хранения в жидком азоте, как показано В. А. Федосеенко, энергия прорастания и всхожесть семян были лучше, чем в контроле, варьируя в пределах 88–99 %.
При сверхнизких температурах хранят только полноценные семена, качество которых не вызывает сомнения. При этом необходимо контролировать уровень хладагента. Так, в случае хранения в жидком азоте при повышении температуры до отметки выше — 120 °C часто наступает гибель семян. Особенно опасен температурный интервал от —80 до —100 °C. Основная причина гибели семян — изменение фазового состояния воды и структуры материала семени. Чтобы этого не случилось, нужно периодически доливать хладагент.
Большое значение в получении качественного семенного материала после снятия с хранения имеет режим расконсервации. Расконсервация семян в условиях комнатной температуры (17–25 °C) часто приводит к полному их разрушению независимо от срока хранения при сверхнизких температурах. Хорошие результаты получают при отогреве семян в восходящем потоке теплого (35–40 °C) воздуха. При этом семена отогреваются во взвешенном состоянии. Наиболее благоприятные условия создаются при расконсервации в проточной, интенсивно перемешиваемой теплой воде (40 °C). В стоячей воде возможно образование ледяного панциря, воздействие которого на покровы и ткани семян приводит к их разрушению.
Следовательно, чтобы при сверхнизкотемпературном хранении не снизилась жизнеспособность семян, необходимо строго соблюдать режим охлаждения и отогрева.
ЛИОФИЛЬНОЕ ХРАНЕНИЕ СЕМЯН
В условиях лиофилизации семена могут храниться весьма продолжительное время. При лиофильной сушке вода удаляется из замороженных семян под вакуумом путем сублимации льда, то есть превращения его в пар, минуя жидкую фазу. Метод лиофилизации предотвращает повреждение семенного материала, позволяет получать сухие семена без потери их структурной целостности и биологической активности. При лиофилизации белки не подвергаются денатурации и семена могут длительное время храниться при температурах несколько ниже 0 °C. В дальнейшем при увлажнении они восстанавливают свои первоначальные свойства. Такой способ хранения особенно подходит для хрупких, нежных семян. В таблице 16 приведены результаты четырехлетнего хранения семян ряда цветочных растений, подвергнутых лиофильной сушке (Come, 1983), Данные таблицы свидетельствуют о высокой эффективности лиофильного хранения семенного материала. Этому, по-видимому, способствует резкое замедление и даже полная остановка метаболических процессов в дегидратированных семенах.

16. Всхожесть лиофилизированных семян, %
ХРАНЕНИЕ ПЫЛЬЦЫ
Скрещивание — один из главных способов выведения новых сортов цветочно-декоративных растений. Технология скрещивания заключается в переносе пыльцы растения отцовской формы на рыльце пестика растения материнской формы. Если периоды цветения обоих растений совпадают, не возникает каких-либо трудностей при таком опылении, но очень часто такого совпадения не происходит. С помощью различных приемов можно искусственно затормозить рост одного растения или ускорить рост другого, изменяя, например, температурный режим культивационного сооружения. Если скрещиванию подвергают растения длинного или короткого дня, то сроками их зацветания можно варьировать, изменяя продолжительность светового периода. Этой же цели служит и посев растений в разные сроки.
Однако, несмотря на разнообразие таких приемов, не всегда удается совместить оптимальные сроки оплодотворения пестика и созревания пыльников тычинок. В этих случаях целесообразно располагать запасом пыльцы, собранной заблаговременно. Для хранения пыльцы сухие, еще не раскрывшиеся пыльники, помещают в стерильную посуду и содержат в холодильной камере при пониженной относительной влажности воздуха. Последняя достигается за счет использования некоторых химических веществ, например хлористого кальция, размещаемого в эксикаторе с пыльцой. В таблице 17 приведены данные о жизнеспособности пыльцы ряда декоративных растений (Korohoda, 1982), часто используемой в работах по скрещиванию и селекции.

17. Жизнеспособность (в сутках) пыльцы при хранении
СНЯТИЕ С ХРАНЕНИЯ И ВОССТАНОВЛЕНИЕ ПОСЕВНЫХ КАЧЕСТВ СЕМЯН
Правильное снятие с хранения и предпосевная обработка семян имеют огромное значение, поскольку на этом этапе возможно необратимое повреждение семян, которое сведет на нет все усилия, затраченные на выращивание и хранение. На всхожесть семян могут влиять отклонения от технологии хранения, температура, влажность и содержание кислорода внутри семенной оболочки.
В некоторых случаях возможно повреждение семенного материала из-за преждевременного прорастания, чему способствует хранение навалом в условиях повышенной влажности, сопровождающееся активным ростом микроскопических грибов. У семян злаковых или бобовых такое развитие микрофлоры возможно не только при повышенной влажности атмосферы хранилища, но и в том случае, если они были заложены на хранение слишком влажными. Влагосодержание семян возрастает с увеличением относительной влажности воздуха в хранилище и может достигать 25 % при относительной влажности воздуха около 95 %. Простое охлаждение семян не снижает содержания влаги в них, устраняя лишь преждевременное прорастание. При этом всегда более благоприятна среда с холодным, но сухим воздухом. Хотя в таких условиях влажные семена не становятся более сухими, но развитие грибов и бактерий устраняется: инактивация грибов наступает при влажности менее 70 %, а для развития бактерий необходима относительная влажность 90 %. Прохладная, но сухая атмосфера особенно благоприятна для семян, которые не переносят высыхания.
Прорастание снятых с хранения семян возможно лишь при благоприятных условиях окружающей среды. Однако многие семена и при благоприятных для прорастания условиях остаются в состоянии покоя, что может быть вызвано двумя причинами: неспособностью покоящегося зародыша к развитию даже при удалении внешних покровов (семенная оболочка, а в некоторых случаях эндосперм) и ингибированием прорастания со стороны внешних покровов, удаление которых приводит к быстрому и нормальному развитию зародыша. У семян некоторых цветочно-декоративных растений могут одновременно действовать обе эти причины.
Иногда семенные оболочки оказывают ингибирующее действие, не пропуская внутрь семени кислород, хотя они проницаемы для влаги. Некоторые оболочки влагонепроницаемы, другие, хотя и пропускают влагу, обладают слишком большим механическим сопротивлением разрыву, что не дает зародышу возможности нормально развиваться. Такие состояния покоя относительны и определяются взаимодействием комплекса факторов, в частности продолжительностью и условиями хранения. Так, семена некоторых травянистых растений, собранные вполне зрелыми, не прорастают в условиях обычных температуры и влажности, но хорошо прорастают после определенного периода хранения в условиях достаточно сухой окружающей среды. После сбора урожая зерновка с трудом прорастает при 20 °C и большой влажности, но легко прорастает спустя два месяца или год после хранения. Хранение при температуре 40 °C в течение нескольких дней может иметь такой же эффект, как и длительное хранение при 20 °C. Если хранить семена при температуре —18 °C, то происходит переход их в состояние покоя, из которого их может вывести специальная обработка.
Существует несколько точек зрения, объясняющих такое явление послеуборочного дозревания. Полагают, что во время хранения устраняются летучие ингибиторы, но более вероятно, что при хранении изменяются покровные структуры зерновки. Непроницаемые для кислорода вначале, они становятся все более проницаемыми в период хранения, и поступление кислорода служит определяющим для развития зародыша. Кроме того, живые клетки оболочки зерновки также потребляют кислород для дыхания, блокируя поступление его к зародышу, эта блокировка постепенно уменьшается с отмиранием покровных клеток.
Для семян розоцветных и некоторых других культур характерно состояние покоя зародыша после хранения. Выведенные из этого состояния зародыши легко прорастают при температуре около 20 °C, в то время как в покоящемся состоянии зародыши не прорастают или этот процесс происходит чрезвычайно медленно и проростки развиваются аномально. Состояние покоя можно прервать, поместив семена в условия низких положительных температур при высокой влажности. В зоне умеренного климата такие условия бывают в конце зимы — начале весны.
Выход из состояния покоя обычно связан с достаточно длительным воздействием низких температур. Причем считается, что зародыш выходит из состояния покоя тогда, когда он начинает быстро расти и нормально развиваться.
Между температурой и продолжительностью ее воздействия для прерывания покоя существует определенная взаимосвязь: чем выше температура, тем продолжительнее обработка. Температурный оптимум для прерывания покоя семян розоцветных культур находится в интервале от 0 до 5 °C; температуры 12–15 °C не оказывают необходимого эффекта. Потребность в низких температурах варьирует у разных сортов растений, но в большинстве случаев хранение при температуре 5 °C в течение нескольких месяцев полностью подготавливает семена к посеву. В некоторых случаях аналогичный эффект вызывает добавка ростактивирующего вещества — гиббереллина.
Нередко прорастанию семян препятствуют толстые покровы ткани, не пропускающие влагу, необходимую для набухания. Семена, которые хорошо набухают, разрыхляются и легко разрушаются, в то время как влагонепроницаемые остаются сухими и противостоят разрушению. Для того чтобы эти семена приобрели водопроницаемость, их необходимо подвергнуть определенной обработке, связанной, как правило, с тем или иным нарушением целостности семенной оболочки. Для этой цели служат скарификация и ударная обработка семян. Последняя, однако, может повредить семени, если будет задет зародыш. Хорошие результаты дает обработка концентрированной серной кислоты с последующей промывкой, но и здесь необходимо четко выдерживать режим обработки, который должен быть достаточно длительным, чтобы разрушить семенную оболочку, но не настолько, чтобы повредить зародышу. В некоторых случаях рекомендуется кратковременное погружение семян в кипящую воду или в жидкий азот. Большая разность температур вызовет термические напряжения, приводящие к растрескиванию семенной оболочки, которая становится проницаемой для воды и кислорода. В таблице 18 указаны приемы предпосевной обработки семян цветочно-декоративных культур после снятия с хранения.

18. Предпосевная обработка семян после снятия с хранения
Семена, утратившие всхожесть, иногда полностью или частично могут восстанавливать ее под воздействием физических обработок. Выход семян из состояния покоя сопровождается гидролизом запасных веществ и накоплением свободных аминокислот, чему может способствовать стимуляция прорастания путем активации гидролитических ферментов гамма-лучами. При длительном же хранении происходит снижение содержания свободных аминокислот и, следовательно, активности ферментов. М. А. Кудиновым были проведены эксперименты с семенами караганы, которые за три года хранения снизили энергию прорастания почти в 4 раза. После облучения дозой 2,58–10
-1Кл/кг энергия прорастания составила 77 % по сравнению с 21 % у необлученных семян, а всхожесть увеличилась с 63 до 92 %. Аналогичные результаты были получены авторами при обработке семян астры однолетней, хранившейся в течение трех лет, коронным разрядом. Всхожесть семян, упавшая практически до нуля, после обработки составила 48 %.
ГЛАВА 6. ХРАНЕНИЕ ВЕГЕТАТИВНЫХ ОРГАНОВ ЦВЕТОЧНЫХ РАСТЕНИЙ ОСОБЕННОСТИ ФИЗИОЛОГИИ ЛУКОВИЦ И КЛУБНЕЛУКОВИЦ
Жизненный цикл луковичных растений характеризуется двумя периодами: роста надземной части и развития дочерних луковиц. Первый период завершается усыханием надземного побега и начинается второй, когда растение живет в виде луковицы, где продолжаются различные биохимические и морфологические процессы, ход которых определяется условиями внешней среды.
Луковицы, предназначенные для получения других луковиц, для ранней или поздней выгонки и т. д., после выкопки нужно какое-то время хранить, чтобы предотвратить повреждение из-за неблагоприятных погодных условий. В противоположность семенам луковицы богаты водой и после уборки отличаются большой физиологической активностью, что отражается прежде всего на интенсивности дыхания. В период хранения продолжается физиологическая эволюция луковицы, и условия хранения в некоторой степени определяют дальнейшее развитие растения. Для луковиц, клубнелуковиц и клубней характерна различная степень зрелости при сборе урожая, поэтому дата выкопки не всегда дает соответствующую информацию о качестве продукции и происходящих при подготовке к хранению процессах.
В период хранения на луковицы решающее воздействие оказывают три фактора: относительная влажность воздуха, его температура и газовый состав. Недостаток влаги вызывает подсыхание луковиц, особенно сильно выраженное у лилии с их сильно развитыми чешуйками. Слишком высокая влажность способствует распространению различных гнилостных инфекций, ботритиса. Распространение в условиях высокой влажности паразитарной микрофлоры может привести к гибели значительной части урожая.
Изменяя температурный режим при хранении, можно управлять последующим развитием растений, в частности устанавливать время инициации цветения, регулировать рост после выведения луковицы и клубнелуковицы из состояния покоя. Обычно (Le Nard, 1983) по своим физиологическим особенностям декоративные луковичные растения, к которым причисляют гладиолус и ирис, подразделяют на три группы. К первой относят гладиолус, лилию, декоративные виды лука и другие растения, для которых характерен сравнительно долгий период прекращения дифференциации новых органов и роста. Этот период, охватывающий время после образования луковицы (или клубнелуковицы), соответствует периоду покоя, который может продолжаться несколько месяцев (гладиолус).
Ко второй группе относятся луковичные растения, не имеющие четко выраженного состояния покоя: тюльпан, гиацинт, нарцисс и некоторые другие. Эти разновидности луковичных растений начинают формирование луковицы непосредственно после дифференциации бутона.
В третью группу входят такие растения, как ирис, у них физиологическое состояние покоя отсутствует. Сразу после выкопки луковицы начинают образование зачатков листьев, дальнейшее развитие которых возможно при средних температурах, но прекращается при повышении температуры до значений, больших 25 °C.
Все три группы луковичных растений, однако, имеют много общего. Если принять за точку отсчета начало образования луковицы или клубнелуковицы, то все последующее развитие можно подразделить на два этапа. На первом этапе, длительность которого зависит от вида растения, не наблюдается роста органов дочерней луковицы даже в том случае, если для этого имеются все подходящие условия. Луковица растет, и в ней происходят процессы созревания. Эта физиологическая эволюция продолжается в дальнейшем при хранении или в естественных условиях в почве, когда луковица становится готовой к росту и развитию. Инициацию последнего вызывает либо низкая, либо повышенная температура.
Как только луковица или клубнелуковица приобрела способность к развитию, начинается второй этап, связанный с быстрым ростом при благоприятном температурном режиме. Для гладиолуса оптимальны высокие и средние температуры, для тюльпана и ириса — пониженные.
Таким образом, период покоя у луковиц или клубнелуковиц характеризуется отсутствием реакции этих вегетативных органов на условия внешней среды. Начало этого периода связано с низкими температурами для клубнелуковиц гладиолуса и с повышенными — для тюльпана и ириса.
Период покоя соответствует слабой меристематической активности, причем физиологическая эволюция в направлении выхода из состояния покоя происходит без видимых признаков органогенеза. Эта эволюция затрагивает структурные изменения в тканях собственно луковиц и клубнелуковиц, тканях донца и зачатка цветка. Дальнейшее развитие будет зависеть от состояния бутона, дифференциации и взаимного соответствия в развитии окружающих тканей.
Клубнелуковицам фрезии свойственна такая же картина покоя и выхода из него, что и тюльпану или ирису. Развитие нарциссов во многом сходно с развитием тюльпанов; то же можно отметить и в отношении других луковичных растений, для них характерны лишь различия в продолжительности того или этого периода онтогенеза, который определяется не только видом и сортом, но и приемами возделывания, погодными условиями.
ТРАДИЦИОННОЕ ХРАНЕНИЕ ЛУКОВИЦ И КЛУБНЕЛУКОВИЦ
К числу наиболее распространенных луковичных цветочных растений принадлежит тюльпан, физиология и биология которого наиболее изучена. В умеренном климате начало развития верхушечной почки тюльпана приходится на довольно раннее время — конец зимы или начало весны, когда луковица увеличивается в объеме. Созревание наступает в конце весны — начале лета, в это время отмирают наружные части растения. Зрелая луковица имеет верхушечную почку, 2–3 зачатка листьев и донце с зачатками корневой системы. Эта дифференциация остается при хранении и отражается на последующем онтогенезе: внутренняя цветочная почка, расположенная у основания луковицы, трогается в рост последней и именно с ней связана инициация цветения.
Таким образом, в конце хранения луковица тюльпана содержит все органы будущего дочернего растения: корневые зачатки, зачатки листьев и цветочную почку. Интенсивность развития этих органов можно регулировать с помощью температуры хранения.
Если луковицы сразу после выкопки подвергнуть воздействию постоянной температуры 17–20 °C, то происходит наиболее раннее раскрытие бутона. Температуры, лежащие выше или ниже указанного диапазона, замедляют развитие тюльпана.
Однако после выкопки луковицы могут находиться под действием переменных температур. Оказывается, что непродолжительное воздействие повышенной температуры обусловливает более быстрое развитие цветка, образование корней и укоренение. Увеличивая продолжительность хранения при повышенной температуре, можно еще более ускорить развитие растения при одновременном увеличении длины цветоноса. В таблице 19 показана зависимость сроков развития цветков и корневой системы тюльпана. Пауль Рихтер при различной продолжительности хранения в условиях повышенных температур (Le Nard, 1983). В качестве контроля использовали луковицы, сразу после сбора урожая высаженные в почву для получения цветов или для наблюдения за развитием корневой системы.

19. Влияние температуры на развитие тюльпана
Из таблицы видно, что для различных целей необходима разная продолжительность хранения при повышенной температуре: быстрое корнеобразование требует более продолжительного воздействия, чем быстрое формирование цветка. После завершения формирования бутона закладываются добавочные цветочные почки. Немедленная тепловая обработка после выкопки ускоряет появление таких цветочных зачатков.
Следовательно, хранение луковиц тюльпана в течение определенного времени при повышенных температурах открывает возможности для более быстрого органогенеза, но возможность эта реализуется лишь при создании затем нормальных агротехнических и температурных условий для выращивания растений. Положительное действие хранения при повышенных температурах отмечено не только на развитие цветка и корневой системы, но и на инициацию цветения у маленьких луковичек, которые без такой обработки не зацветают.
Если луковицы тюльпана хранят при температурах, превышающих 20 °C, то цветочная почка сразу трогается в рост. Рост этот, однако, довольно медленный и ограничивается немногими сантиметрами, считая от вершины луковицы. При такой температуре хранения вытягиваются и корневые зачатки, но, если луковицу высадить в почву и поддерживать ту же или большую температуру, роста корня не наблюдается, удлинения цветоноса не происходит. Хранение при температурах около 20 °C в течение 6–7 месяцев может вызывать сильное подсыхание луковиц. Еще более длительное хранение приводит к тому, что не образуется дочерняя луковица.
В противоположность этому у луковиц, хранящихся при пониженных температурах, происходит быстрый рост цветочной почки, в дальнейшем образуется дочерняя луковица. Влияние пониженных температур при хранении на последующий онтогенез растений определяется величиной температуры, длительностью хранения при данной температуре, временем закладки их на хранение. Если луковицы с полностью сформированной цветочной почкой хранились при разных температурах, то быстрее развиваются те растения, луковицы которых перенесли большее охлаждение. Это относится и к образованию корневой системы, и к надземным частям растений, и к дочерней луковице. Период достижения зрелости такими растениями короче. Низкие температуры одновременно вызывают и повышение скорости роста, и образование дочерней луковицы. При этом снижение температуры хранения имеет определенный предел — наилучшим режимом считается 2 °C. Небольшие отрицательные температуры не приводят к дальнейшему повышению стимулирующего действия, температура — 1 °C в этом смысле эквивалентна температуре 5 °C (Le Nard, 1983). При раннем зацветании ускоряется рост более длинного цветоноса в случае, если луковицы высажены при средних температурах в подходящую почву.
Увеличение длительности хранения при низких температурах способствует более быстрому росту и формированию дочерней луковицы, образованию более длинного, но менее прочного цветоноса. Чрезмерное увеличение срока хранения (до 25 недель и более) приводит к отрицательным результатам: цветонос становится короче, цветы выглядят больными, растения имеют небольшую высоту и истонченные листья.
Положительный эффект низкотемпературного хранения может быть сведен на нет выдержкой луковиц в течение некоторого времени при повышенных температурах. Развитие луковиц, хранившихся первоначально при низких температурах, а затем подвергнутых действию повышенных температур, будет зависеть, с одной стороны, от стимуляции луковиц, обусловленной воздейсвием холода, и с другой — от продолжительности тепловой обработки. Если луковицы подвергают действию пониженных температур не сразу после выкопки, а с некоторой задержкой, то образование дочерних луковиц продолжается при повышении температуры.
Тюльпаны наиболее широко используют в промышленном цветоводстве для выгонки в зимне-весенний период. С подготовкой к выгонке связаны некоторые особенности технологии хранения. Различают так называемые стандартный метод хранения и пятиградусную технологию (Ругите, 1986).
При стандартном методе для получения цветов от 23.02 до 08.03 поступают следующим образом. После выкопки, примерно с 15.07 по 01–10.10 луковицы хранят при температуре 20 °C. Часть высаживают отдельными партиями с 01 по 11.10. Другую часть луковиц хранят в холодильнике при температуре 7–9 °C, начиная с 11.10. С 01.12 температуру хранения снижают до 2–3 °C. После 25.01 луковицы партиями поставляют в теплицу на выгонку при температуре 16–18 °C. Цветение тюльпанов наступает через 3,5–4 недели.
Для выгонки берут здоровые, хорошо просушенные луковицы диаметром не менее 3,5 см. При закладке на хранение их располагают в специальных ящиках с решетчатым дном на ножках. Скважистость продукции (заполнение ящиков) должна быть такой, чтобы обеспечивать нормальную аэрацию. Ящики с луковицами при штабелировании не должны соприкасаться со стенами и полом хранилища. Необходимо обеспечивать хорошее проветривание и кондиционирование хранилища. Луковицы следует предохранять от прямого воздействия солнечных лучей. В помещении поддерживают температуру 20 °C. Если это условие не соблюдается (неотапливаемое помещение, температура которого зависит от температуры окружающего воздуха), то точность срока выгонки не может быть обеспечена. Кроме того, при этом возможно ухудшение качества цветов.
Высадку луковиц проводят в почву среднего механического состава, объемная масса которой составляет 400–600 кг/м
3, рН 6,5–6,8. Желательно, чтобы почва была предварительно пропарена. За 2–3 дня до посадки субстрат поливают и перемешивают. Если добавляется торф, то воду целесообразно заменить 0,2 %-ным раствором кальциевой селитры. Желательно в качестве посадочной тары использовать чистые ящики из-под винограда или сливы. Ящики ставят в штабеля в шахматном порядке или приподнимают с помощью специальных планок, чтобы ростки не касались дна вышестоящего ящика. В каждый ящик укладывают луковицы примерно одного размера. Промежуток между луковицами должен быть 1–2 см. В ящике размерами 70×40×8 см размещают около 70–80 луковиц, затем их осторожно, чтобы не сдвинуть, присыпают землей. После полива верхушки луковиц должны выступать на поверхность. Укоренение проводят в холодильнике. Холодильная камера должна быть темной, хорошо проветриваемой, иметь устройства регулирования температуры и влажности. Необходимо следить за тем, чтобы нижние ящики не повреждались (в ярусе не должно быть более десяти ящиков). Первые 3–4 недели поддерживают температуру 9 °C. После укоренения, когда сквозь щели ящиков показываются корешки, температуру понижают до 7 °C, а примерно с 01.12 — до 2–3 °C. Влажность воздуха должна быть на уровне 90–95 %. Чтобы не допустить пересыхания почвы, проводят поливы. Для предотвращения загнивания корней и ростков камеру периодически проветривают. В таком режиме растения содержат 14–16 недель. Нормально подготовленные тюльпаны имеют ростки длиной 3–5 см и корни, проросшие сквозь щели ящиков на 3 см.
Если луковиц сравнительно немного и в хозяйстве нет холодильника, укоренение проводят в траншеях или парниках, причем под ящики подстилают еловый лапник для предотвращения повреждения корней. Почву в ящиках покрывают слоем перлита или песка. С наступлением морозов траншею засыпают опилками или известковым торфом. Сверху размещают парниковые рамы или покрытие из рубероида. При сильном похолодании траншею укрывают утепляющим материалом, а во время оттепели рамы приподнимают для вентиляции.
Для выгонки в ящиках к 23.02–08.03 используют сорта Оксфорд, Парад, Апельдорн, Лондон, Дипломат. Если посадочный материал доставлен из южных регионов, зацветание тюльпанов происходит на несколько дней раньше, но при затянувшейся транспортировке получают урожай меньший и более низкого качества по сравнению с луковицами местной репродукции.
Поскольку тюльпаны не очень требовательны к свету, при рассмотренном способе выгонки можно использовать грунтовые и стеллажные теплицы как с пленочным, так и со стеклянным ограждением. Теплицы предварительно дезинфицируют, очищают, проветривают, почву перекапывают и за два дня до помещения в них растений выравнивают и поливают.
Луковицы тюльпана помещают в теплицу за 3,5–4 недели до желательного срока цветения. В теплице с ростков удаляют остатки чешуи и опрыскивают водой из пульверизатора. В день переноса луковиц в теплицу температура воздуха в ней не должна превышать 14 °C, в последующие дни температуру поддерживают на уровне 16–18 °C, но не выше 20 °C (в солнечную погоду). Если температура ниже рекомендуемой на 2 °C, то цветение запаздывает на неделю. Тюльпаны интенсивно растут и в течение 1–3 дней подрастают на 5–8 см в зависимости от сорта. Полив проводят в первой половине дня умеренно и осторожно, следя за тем, чтобы вода не попадала на листья. Теплицу часто проветривают. В зависимости от сорта тюльпаны зацветают через 20–24 дня.
В середине 60-х годов в Голландии была разработана
пятиградусная технология, отличающаяся от обычной тем, что луковицы хранят при 5 °C и затем высаживают в гряды. При этом существенно (в четыре раза) сокращается потребность в площади холодильных камер, но резко возрастают требования к точности соблюдения температурного режима: его поддерживают с точностью ±0,5 °C. Такую технологию применяют для выгонки тюльпанов к Новому году и 8 Марта. Основные технологические режимы, например для сорта Парад (по Я. Ругите), следующие. С момента выкопки (15.07) по 17.10 луковицы выдерживают в хранилище при температуре 20 °C; с 18.10 по 18.01 (не менее 12 недель) — при температуре 5 °C в холодильнике, где поддерживают относительную влажность воздуха 80–85 %. Если холодильник работает неравномерно и на некоторое время отключается, то луковицы образуют цветонос позже. Помещение часто проветривают, луковицы содержат в тех же ящиках, что и в неохлаждаемом хранилище. При небольших объемах хранения можно использовать бытовой холодильник, вмещающий до 2000 луковиц. Накануне высадки луковицы тюльпанов переносят в помещение с температурой 14–16 °C. Затем их осторожно раскладывают в рядки, чтобы не повредить корневых зачатков. Высадку проводят 19.01 в остекленную или пленочную теплицу, проветренную и продезинфицированную, число луковиц 200–250 на 1 м
2. Посадки обильно поливают и первые две недели поддерживают температуру почвы на уровне 10–11 °C, воздуха — около 11–13 °C. В дальнейшем температуру воздуха повышают до 16–18 °C. Тюльпаны зацветают через 6–8 недель.
Ксифиум (луковичный ирис) имеет цикл развития, весьма сходный с циклом развития тюльпана. В умеренном климате высаженные осенью луковицы быстро укореняются, трогаются в рост ранней весной и отцветают, образуя дочернюю луковицу в середине лета.
Однако если у тюльпана процесс дифференциации и развития в первые недели после выкопки происходит при относительно высоких температурах, то у луковиц ириса этот процесс начинается непосредственно после высадки, то есть в осенне-зимний сезон при низких температурах.
При выкопке луковицы апикальная почка роста обычно имеет три листовых зародыша, но последующая эволюция этой почки зависит от ряда факторов. Один из решающих факторов — объем луковицы и ее масса: существует некоторая «критическая масса», величина которой варьирует в зависимости от сорта. Ниже этой критической величины невозможна инициация цветения из апикальной почки, помимо листьев, развиваются чешуйки, возникает дочерняя луковица.
Большое влияние имеет температура. При 20 °C и выше происходит инициация цветения, но полностью цветок развивается лишь при понижении температуры до средних или низких значений. Наиболее благоприятной для развития цветоноса считается температура 9—15 °C (Le Nard, 1983). Таким образом, повышение температуры создает необходимые, но недостаточные условия для развития цветка. Последнее возможно лишь при оптимальной пониженной температуре внешней среды.
Следует отметить, что длительность хранения при повышенной температуре должна быть тем больше, чем ближе масса луковицы к критической. Обычно луковицы ириса хранят при 25–30 °C в течение достаточно продолжительного времени. При этом луковица бывает подготовлена к выгонке в любое заданное время, причем развитие цветоноса после высадки будет определяться условиями окружающей среды.
Слишком ранний переход к хранению при пониженных температурах ограничивает развитие апикальной почки, вследствие чего образуются 2–3 листа и чешуйки, органогенез замедляется. Если перед закладкой на хранение при пониженных температурах проводят тепловую обработку, образование дочерней луковицы начинается раньше и протекает более быстро, что вызвано положительным влиянием повышенных температур на мобилизацию резервов роста луковицы. При одном и том же режиме низкотемпературного хранения кратковременная выдержка луковиц при повышенных температурах приводит к образованию меньшего количества листьев, но более мощному развитию цветоноса и раннему и обильному цветению. При удлинении периода хранения в условиях повышенных температур развитие цветочной почки происходит быстрее. Экспериментально установлено, что наилучший режим для получения хорошо развитого цветка — это хранение 12 недель при температуре 30 °C и далее в течение 16 недель при 10 °C.
Развитие
гладиолуса в условиях умеренного климата существенно отличается от развития тюльпана или ириса. Клубнелуковицы высаживают весной, сразу после высадки начинается развитие зачатков цветков. В течение весны и лета происходит рост надземных органов растений. Образующуюся дочернюю клубнелуковицу выкапывают осенью и закладывают на зимнее хранение. Почки, из которых затем развиваются надземные органы дочернего растения, образуются весьма рано. При формировании дочерней клубнелуковицы ко времени выкопки уже имеется верхушечная почка с несколькими зачатками листьев. Скорость развития верхушечной почки и в целом развитие дочернего растения в сильной степени зависят от температурного режима хранения.
Сразу после выкопки клубнелуковицы и клубнепочки не прорастают даже при благоприятных условиях внешней среды. Раннее развитие цветочной почки и образование корней зависят от сорта гладиолуса и условий образования клубнелуковицы: повышенные температуры и хорошая освещенность способствуют более раннему развитию. Большое влияние на этот процесс оказывают также температура и влажность в период хранения клубнелуковиц. Низкая температура (5—10 °C) обусловливает приобретение способности к быстрому росту, однако оптимальная длительность хранения в этом диапазоне температур зависит от сорта и физиологического состояния клубнелуковиц к моменту выкопки. Клубнепочки, как правило, нуждаются в более длительном холодном хранении, чем клубнелуковицы.
При пониженных температурах практически не происходит органогенез, он проявляется лишь при температурах около 20–25 °C. Поэтому, чтобы получить одновременные обильные всходы, целесообразно первоначальное холодное хранение сменить выдержкой при повышенных температурах. Такая технология хранения не только обеспечивает быстрый органогенез, но и влияет на все последующее развитие растений — образование листьев, цветоноса, дочерней клубнелуковицы и т. п. Однако слишком длительная высокотемпературная выдержка может иметь и отрицательные последствия, выражающиеся в уменьшении высоты цветоноса и числа цветков на нем. Выдержка при повышенной температуре, длительность которой не превышает оптимального предела, не только ускоряет развитие растений, но и влияет на массу и форму дочерней клубнелуковицы (она становитcя более шарообразной).
Длительное хранение при температуре 2–4 °C обеспечивает состояние покоя, из которого клубнелуковицы выводят путем переноса в помещение с температурой 20 или 30 °C.
Выдержка при более высокой температуре (30 °C) способствует ускоренному развитию растения, а температура 20 °C благоприятна для развития дочерней клубнелуковицы.
Период хранения клубнелуковиц может быть довольно длинным — до 6–7 месяцев. Результаты хранения определяются комплексом факторов: качеством заложенной на хранение продукции, температурно-влажностным режимом хранения, пораженностью паразитарной микрофлорой.
После выкопки клубнелуковицы, как указывает Т. Г. Тамберг, подсушивают на воздухе в течение нескольких часов, затем укладывают в ящики и направляют в сушильное помещение с температурой 20–25 °C. Затем температуру следует повысить до 30–35 °C, одновременно проводя проветривание помещения. Просушка продолжается в течение недели. Быстрая просушка способствует подавлению развития паразитарных грибов, прежде всего ботритиса. После досушивания и сортировки клубнелуковицы помещают в хранилище, где поддерживают постоянную температуру на уровне 5 °C при относительной влажности воздуха 50–70 %. Период естественного покоя клубнелуковиц составляет 30–40 дней. Хранение при пониженных температурах обусловливает состояние вынужденного покоя клубнелуковиц, отличающееся от естественного тем, что при благоприятных влажности и температуре возможно их прорастание. Чтобы не произошло преждевременного прорастания, при необходимости снижают температуру до 2–5 °C и лишь за 15–20 дней до высадки ее повышают для стимуляции пробуждения клубнелуковиц и подготовки их к прорастанию и образованию корневых бугорков. В зависимости от цели, которую ставят при выращивании растения: получение дочерней луковицы или цветков на срезку, устанавливают соответствующий температурный режим: 15 °C в первом случае и 25–30 °C во втором.
Клубнепочки хранят при температуре 5 °C отдельно от клубнелуковиц в марлевых или бумажных упаковках, разделенными на фракции. Необходимо следить за тем, чтобы температура при хранении клубнепочек не повышалась, так как это ухудшает их посевные качества. Хранение при температуре 20 °C может привести к полной потере всхожести.
При хранении клубнелуковиц и клубнепочек в помещении должны быть обеспечены вентиляция и циркуляция воздуха, что предотвращает накопление некоторых вредных продуктов обмена, в частности этилена. Неравномерная влажность может послужить причиной загнивания, плесневения и физиологических заболеваний посадочного материала. Физиологические заболевания нередко проявляются в виде «меловых пятен» на поверхности клубнелуковиц.
Некоторые особенности присущи технологии хранения луковиц
нарцисса. Они созревают в конце мая — начале июня. Оптимальной считается выкопка в июне (до 1 июля). Перед закладкой на хранение луковицы хорошо просушивают. После просушки их очищают от земли и остатков листьев, сортируют по фракциям.
На хранение закладывают в ящики с сетчатым дном, которые располагают штабелями при условии свободного доступа воздуха. Первые две недели хранение проводят при температуре 22–24 °C и влажности воздуха 70–80 %. Последующее время, вплоть до высадки, луковицы следует хранить при 16–18 °C.
Для выгонки
лилии в различное время года необходимо хранить луковицы в течение времени, определяемого сроком выгонки. Хранение луковиц при низких температурах при этом, с одной стороны, обеспечивает после хранения ускорение роста, с другой — возможность получать цветы осенью из луковиц урожая текущего года. Изменяя температуру в хранилище и время хранения, можно регулировать сроки цветения при выгонке.
Обычно, чтобы предотвратить потерю воды луковицами, их хранят в слегка увлажненном субстрате. Однако влажная среда способствует более раннему прорастанию лилий и образованию корней. Сухое же хранение луковиц приводит к потере ими влаги и усыханию. Эти подсохшие луковицы цветут позже и дают меньше цветов. Такое хранение целесообразно использовать, когда нужно обеспечить выгонку лилий поздней зимой или весной. Идеальными условиями хранения можно считать такие, которые приближаются к природным. На долю воды приходится примерно 2/3 массы луковицы, поэтому оптимальная влажность окружающей среды должна лишь слегка превосходить значение, соответствующее равновесной влажности самой луковицы. Оказывается, что такие условия можно создать с помощью полиэтиленовых пакетов, выложенных изнутри газетной бумагой. Применение подобной технологии хранения дает возможность в ноябре или декабре получить выгоночные цветы лилии из урожая текущего года, что не требует длительных сроков хранения. Максимальное ускорение цветения достигается при хранении собранного свежего урожая луковиц в течение 5–6 недель при температуре 2—10 °C. Для длительного хранения рекомендуется использовать полиэтиленовые пакеты с бумажной обкладкой изнутри, температура хранения при этом должна быть около 0 °C и относительная влажность воздуха -50 %.
ХРАНЕНИЕ ЛУКОВИЦ И КЛУБНЕЛУКОВИЦ В МОДИФИЦИРОВАННОЙ ГАЗОВОЙ СРЕДЕ
Сохранность посадочного материала (луковиц, клубнелуковиц) зависит как от его качества, так и от условий окружающей среды, в частности газового состава и температуры. Именно этими факторами определяется интенсивность дыхания луковиц или клубнелуковиц. Сохранность заложенной на длительное время продукции будет тем выше, чем меньше интенсивность дыхания, зависящая от состава МГС.
Хотя интенсивность дыхания различных вегетативных органов цветочных растений варьирует даже в пределах одного вида при расчетах, связанных с определением оптимальных параметров МГС, можно использовать некоторые усредненные показатели. Интенсивность дыхания (К) ряда сортов гладиолуса и тюльпана характеризуется следующими величинами, (м
3/кгс)•108:

Характерно, что интенсивность дыхания луковиц тюльпана ниже, чем клубнелуковиц гладиолуса.
Измерения интенсивности дыхания проводили при хранении в холодильной камере клубнелуковиц или луковиц в сосуде, соединенном с манометром. Определяли интенсивность дыхания с помощью соотношения (1).
Расчет газоселективных мембран для хранения клубнелуковиц гладиолусов можно проводить с помощью соотношений (9—11).
Рассчитаем площадь мембраны полимерного контейнера для хранения 10 кг (200 штук) клубнелуковиц гладиолусов, исходя из рекомендуемого режима хранения, характеризующегося концентрациями ξ
1=3 % и ξ
2=4–5 %. Для этого, пользуясь приведенными выше данными, по интенсивности дыхания клубнелуковиц определим значение параметра μ
0 по формуле μ
0=p
1p
1/K
o:
μ
0 = (2,110
4•1,49•10
-9)/(6,9•10
-9)= 4,54•10
3 кг/м
2.
Здесь проницаемость мембраны принята 1,4410
-9 м
3/(с•Н). Селективность этой мембраны σ = 3,7. Определяем загрузку мембраны по формуле (11):
μ = (21/3-1)4,54.10
3 = 2,72.10
4 кг/м
2.
Для хранения 10 кг клубнелуковиц контейнер должен иметь мембрану площадью:
S=10/(2,7210
4)=3,7•10
-4 м
2≈4 см
2
Концентрация углекислого газа при этом составит
ξ
2 = 1/3,7(21-3)=4,9 %,
что находится в допустимом диапазоне. Дыхательный коэффициент δ здесь принят равным 1.
В Северокавказском совхозе цветочного семеноводства (Майкопский район Краснодарского края) были поставлены эксперименты по хранению клубнелуковиц гладиолуса сорта Оскар. Клубнелуковицы находились в контейнерах с мембранами типа ПВТМС, в контроле хранение проводили в открытой таре на стеллажах. Часть клубнелуковиц хранили в сетках, подвешенных к кронштейну. Параметры, характеризующие результаты хранения, приведены в таблице 20. Наилучшая сохранность клубнелуковиц была при размещении их в контейнерах с мембранами.
20. Результаты хранения клубнелуковиц гладиолуса сорта Оскар
Для объективных выводов об успешности той или иной технологии хранения была проведена проверка посадочного материала в полевых условиях. Выращивание вели на хорошо освещаемом, незатемненном участке с выровненным рельефом и одинаковой почвой в пределах участка. На протяжении предшествующих четырех лет на территории участка выращивали одни и те же культуры с идентичной агротехникой. Реакция почвенного раствора была близка к нейтральной (рН 7,5). Основная масса гладиолусов цвела во второй и третьей декадах сентября. Выкопку проводили в первой декаде октября. Те клубнелуковицы, которые имели лучшие показатели в период хранения, дали хорошие результаты в течение вегетации. В вариантах контейнерного хранения с мембранами ПВТМС менее всего было клубнелуковиц, не давших всходов или пораженных болезнями.
ПРИМЕНЕНИЕ ЭЛЕКТРОФИЗИЧЕСКОЙ ОБРАБОТКИ ПРИ ХРАНЕНИИ ЛУКОВИЦ И КЛУБНЕЛУКОВИЦ
Для сохранения товарного качества луковиц и клубнелуковиц цветочных культур перспективно использование метода, основанного на применении аэроозонной и аэроионной их обработки.
При аэроозонной обработке в разные периоды хранения луковиц и клубнелуковиц на них воздействуют смесью, содержащей в той или иной концентрации озон. Озон, будучи сильным бактерицидным и фунгицидным агентом, позволяет уничтожать очаги микрофлоры и регулировать дыхательные и обменные процессы в хранящемся посадочном цветочном материале.
Экспериментально показано (Гросман, 1981), что при хранении луковиц тюльпана и клубнелуковиц гладиолуса в условиях температуры 4–5 °C, относительной влажности воздуха 72–76 % и обработки их 2 раза в неделю по 1–2 ч аэроозонной смесью (концентрация озона 30–40 мг/м
3) заболевания посадочного материала сократились на 70–80 % по сравнению с контролем. Биохимические исследования подтвердили повышенную жизнеспособность луковиц и клубнелуковиц при таком хранении.
Следует отметить, что применение барьерного разряда, при котором выделяется озон, возможно, по-видимому, лишь при условии кратковременности обработки. По нашим данным, длительная обработка (60 мин) приводит к гибели части клубнелуковиц. То же происходит и при длительной обработке коронным разрядом (30 мин). Напротив, кратковременная обработка коронным разрядом в течение 15 мин оказывает заметное стимулирующее действие на посадочный материал.
Действие барьерного и коронного разрядов на хранящиеся луковицы или клубнелуковицы неодинаково. Барьерный разряд, при котором выделяется озон, фактически обеспечивает только дезинфекцию посевного материала, тары и хранилища. Этот разряд горит при переменном токе, вследствие чего какого-либо упорядоченного движения заряженных частиц не происходит.
Имеющаяся информация о действии заряженных частиц и пропускании гальванического тока на скорость роста растений (Стрельцов, 1986) позволяет сделать предположение о зависимости некоторых метаболических процессов, в частности интенсивности дыхания, от этих факторов. Поскольку интенсивность дыхания во многом определяет сохранность луковиц и клубнелуковиц в течение длительного времени, представляется целесообразным выяснить степень влияния такого рода обработок на изменение этой величины.
Рис. 19. Установка для определения интенсивности дыхания. Обозначения в тексте
Исследования проводили следующим образом (рис. 19). Партию луковиц или клубнелуковиц 3 взвешивали, помещали в герметичный сосуд 4 емкостью V
c соединенный с манометром 8. Внутри сосуда находилась небольшая емкость 2 с аскаритом — веществом, хорошо поглощающим углекислый газ. Затем проводили наблюдения за изменением давления внутри сосуда, отражающемся в поднятии жидкости (окрашенная вода) в том колене водяного манометра, которое соединено с сосудом. Выделенный при дыхании углекислый газ поглощался и давление внутри сосуда падало. Интенсивность дыхания можно определить с помощью соотношения (1) и для нашего случая привести к следующему виду:
К=(V
c-V
1)/m (Δh)/(Δt)
где V
1 — объем луковиц, м
3; Δh — перепад давления (мм) в течение времени Δt, с; m — масса луковиц, кг.
Для количественной оценки влияния коронного разряда на интенсивность дыхания использовали установку (см. рис. 19), в крышке 5 которой имеется диэлектрическая пробка 6 с иглами коронирующего электрода 7. Подставку 1, на которой расположены луковицы, заземляют через микроамперметр.
Соотношение Δh/Δt, характеризует интенсивность дыхания, то есть чем больше угол а (рис. 20), тем интенсивность дыхания выше. После измерения интенсивности дыхания необработанных клубнелуковиц эти клубнелуковицы были подвергнуты обработке с помощью коронного разряда. Клубнелуковицы обрабатывали при токе коронного разряда 15 мкА в течение 30 мин. Характеристике h = f(t) соответствует линия 3 на рисунке 20. При перемене полярности (положительный разряд) интенсивность дыхания возрастает (кривая 1).

Рис. 20. Зависимость дыхания (перепада давления) от электрофизической обработки: 1 — потенциал положителен; 2 — без обработки; 3 — потенциал отрицателен
Таким образом, применение отрицательного коронного разряда, включаемого периодически, может привести к снижению интенсивности дыхания клубнелуковиц, находящихся во внешней зоне этого разряда, причем апикальная почка их обращена в сторону коронирующего электрода.
Кроме коронного разряда, клубнелуковицы гладиолусов можно обрабатывать постоянным электрическим током, пропускаемым как в направлении от донца к верхушечной почке (в верхушечную почку вставляют электрод отрицательной полярности), так и в обратном направлении. Этот вид обработки не связан с громоздким и требующим специального ухода и обслуживания высоковольтным оборудованием, для него вполне достаточно иметь низковольтный источник тока (напряжением 5—20 В). Прохождение такого тока через растительные ткани также снижает интенсивность дыхания продукции.
Имеется связь между скоростью роста и током, проходящим через растение. По-видимому, электрическая поляризация влияет на направление движения гормонов в различных органах растений. Концентрация некоторых гормонов увеличивается в местах с положительным зарядом и уменьшается там, где имеется отрицательный заряд. Следовательно, можно сделать вывод, что ростовой гормон перемещается в направлении увеличения положительного потенциала. Ростовые гормоны типа ауксинов представляют собой кислоты. Анион такой кислоты, то есть физиологически активная часть, передвигается к положительному электроду, и электрическое воздействие на хранящиеся луковицы или клубнелуковицы вызывает, вероятно, перераспределение концентрации ингибирующих и ростактивирующих веществ. Большинство последних в растворах диссоциирует, образуя анионы и катионы, передвигающиеся в электрических полях, чем и определяется то или иное воздействие электрофизической обработки.
ХРАНЕНИЕ КОРНЕВЫХ ЧЕРЕНКОВ
Размножение некоторых декоративных растений с помощью неодревесневших черенков с корнями имеет целый ряд преимуществ, заключающихся в последующем быстром росте растений весной. Главное затруднение, встречающееся при этом, — значительный отход хранящихся черенков, который можно уменьшить рациональным выбором условий хранения.
Растения в виде неодревесневших корневых черенков закладывают на хранение осенью в полиэтиленовых пакетах по десять черенков в каждом и хранят в темном помещении с контролируемой температурой. Внутренность пакетов и черенки можно обработать фунгицидами для предотвращения грибных заболеваний. Весной черенки высаживают в обеззараженную смесь листовой земли и перлита: в таблице 21 приведены результаты экспериментов по хранению черенков в двух температурных режимах (0° и 5 °C) с обработкой фунгицидами и без нее.

21. Количество сохранившихся черенков после хранения (ноябрь — май), %
Применение фунгицидов не всегда способствует хорошей сохранности одревесневших черенков. По-видимому, на их сохранность влияет не только наличие или отсутствие паразитарных грибов, но и сами условия хранения в течение продолжительного времени. В некоторых случаях фунгициды даже уменьшают устойчивость черенков к действию внешней среды, что особенно проявляется в условиях более высоких температур.
Как правило, выживаемость черенков превышала 50 %, причем этот предел повышался в условиях хранения с температурой 0 °C.
При высаживании черенков в почву оказалось, что более быстрым ростом отличаются черенки, хранившиеся при 5 °C. Это, возможно, связано с легким повреждением корневой системы, которое могло быть при более низких температурах. Чтобы устранить это нежелательное явление, целесообразно неодревесневшие черенки хранить при температуре 0–2 °C.
СНЯТИЕ ЛУКОВИЦ И КЛУБНЕЛУКОВИЦ С ХРАНЕНИЯ, ИХ ПРЕДПОСАДОЧНАЯ ОБРАБОТКА
При хранении луковиц и клубнелуковиц в правильно выбранном режиме они находятся в состоянии покоя, выход из которого возможен с помощью стимуляции, заключающейся в резкой перемене температурного режима хранения. Особенно длительным и глубоким бывает состояние покоя у гладиолуса, для того чтобы подготовить клубнелуковицы к выгонке, их обрабатывают различными химическими веществами, к числу которых относятся этилен, метанол и некоторые цитокинины. Эти вещества прерывают состояние покоя и стимулируют развитие растений.
Одним из эффективных методов стимулирования онтогенеза и предпосадочной обработки клубнелуковиц гладиолуса и луковиц тюльпана служит обработка их во внешней зоне коронного разряда с помощью установки, показанной на рисунке 21. Разряд при этом должен быть отрицательным.

Рис. 21. Блок-схема установки для электроаэроионной обработки цветочной продукции: К — коронатор; R — сопротивление; D — диод; Тsub1/sub и Тsub2/sub — трансформаторы; А — амперметр; V — вольтметр
Для определения стимулирующего действия коронного разряда и озонно-аэроионной обработки была взята 1000 клубнелуковиц гладиолусов, которые разделили на пять групп по 200 в каждой. Проверяли действие озона (200 мг/м
3) в течение 30 и 60 мин и действие коронного разряда (100 мА/м
3). Для получения озона применяли барьерный разрядник, для получения коронного разряда — набор игольчатых электродов. Обработку коронным разрядом проводили 15 и 30 мин.
По-видимому, наиболее целесообразна обработка коронным разрядом в течение 15 мин. Именно в этом варианте были наименьший отход и наибольший урожай клубнелуковиц (Стрельцов, 1986). Кроме того, такая обработка стимулирует образование клубнепочек. При 15-минутной обработке было получено наибольшее их количество. Озонная обработка в течение 30 мин дала некоторое улучшение качества урожая клубнелуковиц, в частности снижалась пораженность их заболеваниями. Обработка в течение 1 ч привела к значительным потерям, часть клубнелуковиц не прорастала.
Изучалось также влияние постоянного электрического тока на стимуляцию онтогенеза. При этом предпосадочная обработка имеет много общего с обработкой постоянной короной: и в том и в другом случае через клубнелуковицу (или луковицу) проходит небольшой электрический ток (несколько микроампер) в направлении от донца к верхушечной почке (или наоборот). Обрабатывали партии по 100 клубнелуковиц гладиолуса, такая же партия была высажена в грунт без обработки (контроль). Результаты учета урожая клубнелуковиц приведены в таблице 22.

22. Учет урожая клубнелуковиц при электрообработке
Предпосадочная обработка клубнелуковиц гладиолуса постоянным током разной полярности показывает, что увеличение значения тока отрицательной полярности до 7 мкА вызывает как возрастание диаметра клубнелуковиц, так и увеличение числа клубнепочек. В то же время обработка клубнелуковиц током положительной полярности до 7 мкА приводит к противоположным результатам.
Опыты по электрофизической стимуляции проводили и с тюльпанами. Проверяли эффективность стимуляции онтогенеза растений при пропускании электрического тока между донцем и верхушечной почкой.
Методика проведения обработки состояла в следующем. Электрический ток пропускали в направлении донце-верхушечная почка и обратно. Затем луковицы тюльпанов (вместе с контролем) высаживали на специально подготовленном опытном участке. Участок имел выровненный рельеф, однородную почву. Ранее (на протяжении предшествующих пяти лет) на участке выращивали одни и те же культуры при одинаковой агротехнике. С осени под перекопку вносили хорошо перепревший навоз. Реакция почвенного раствора была близка к нейтральной (рН≈7). Клубнелуковицы гладиолуса высаживали в почву 24 мая. К 20 июня из общего числа высаженных клубнелуковиц гладиолуса при обработке током — 7 мкА развилось 82,5 % нормальных растений; +7 мкА — 81 %; в контроле — 89 и при обработке током — 15 мкА — 76 %.
Луковицы тюльпана, обработанные отрицательным током (—7 мкА), после высадки формировали более мощные и высокие растения, развитие которых несколько ускорялось.
ГЛАВА 7. ТЕХНИЧЕСКИЕ СРЕДСТВА ДЛЯ ХРАНЕНИЯ ЦВЕТОЧНОЙ ПРОДУКЦИИ
Применяемые в промышленном цветоводстве технические средства для хранения продукции можно разделить на следующие группы: холодильная техника; техника обеспечения гипобарического хранения; электрофизическая техника; средства хранения в регулируемой газовой среде.
От того, насколько эффективно и правильно будет использован тот или иной вид аппаратуры и оборудования, во многом зависит успех хранения.
ХОЛОДИЛЬНАЯ ТЕХНИКА
Холодоснабжение, применяемое для хранения свежей сельскохозяйственной продукции, может быть децентрализованным, при котором каждая камера или отсек хранилища имеет свою индивидуальную холодильную установку или агрегат, или централизованным, когда одна холодильная машина обеспечивает холодом все камеры.
Централизованная схема холодоснабжения связана с использованием мощного холодильного оборудования, обычно применяемого в многокамерных хранилищах большой вместимости, где хранится 3—10 тыс. т. плодоовощной продукции. Такая схема в промышленном цветоводстве практически не применяется.
Децентрализованное холодоснабжение целесообразно и экономично для холодильников и холодильных камер вместимостью 5—100 т и менее, его широко используют при хранении цветочной продукции. Это позволяет применять холодильные агрегаты полной заводской готовности без больших затрат на строительство машинных залов и сложной системы питания хладагентом и обслуживания. Такое холодоснабжение может обеспечить холодильное хранение как в специализированных хозяйствах, так и в различных подсобных помещениях.
Для охлаждения продукции применяют батарейные, воздушные и смешанные системы выработки холода. При батарейной системе продукция охлаждается от холодильных элементов-батарей, установленных в холодильной камере. Происходит отбор тепла из объема хранилища холодильным агентом, циркулирующим в системе. В системах воздушного охлаждения холодный воздух подается вентилятором непосредственно в камеру с продукцией. Система смешанного охлаждения обеспечивает холодом камеры с продукцией при комбинированном использовании батарей и вентиляторов.
В практике холодильного хранения сельскохозяйственной продукции в качестве хладагента применяют аммиак, а также специальные хладагенты типа R12, R22 (фреоны).
Для применения в цветоводческих хозяйствах представляют интерес машины и агрегаты серии МВБ, МКВ, АВ и АК.
Машины типа МВВ имеют воздушное охлаждение конденсатора, МКВ — водное охлаждение. В состав этих машин входят: компрессор, конденсатор, фильтр-осушитель, теплообменник, щит приборов и управления. Машины автоматизированные, компрессионные с устройством для автоматического оттаивания снеговой подушки. Они комплектуются воздухоохладителями (за исключением машин МВВ4-1-2 и МКВ4-1-2, снабженных настенными испарителями естественной циркуляции).
Агрегаты типа АК с водным охлаждением конденсатора представляют собой безрамную конструкцию, в которой компрессор, фильтр-осушитель и два реле управления установлены на конденсаторе. Агрегаты АВ с воздушным охлаждением состоят из компрессора, конденсатора, вентилятора с электродвигателем, ресивера и фильтра-осушителя. Все агрегаты снабжены теплообменником и автоматической защитой по давлению всасывания и нагнетания.
Схема наиболее распространенной в современной холодильной технике паровой компрессионной холодильной машины приведена на рисунке 22 (Бражников, 1984).
Из конденсатора 2 жидкий холодильный агент, имеющий высокое давление (до 1,2–1,4 МПа) и температуру t
к, поступает к устройству, позволяющему снижать давление хладагента, — регулирующему вентилю 1, после которого агент попадает в трубопровод испарителя 4. Открывая или закрывая регулирующий вентиль, можно изменять (повышать или понижать) давление в испарителе. При понижении давления в испарителе создаются условия, при которых хладагент кипит. Необходимую для кипения теплоту холодильный агент получает от продукции, находящейся в холодильной камере, тем самым охлаждая ее.

Рис. 22. Схема паровой компрессионной машины. Обозначения в тексте
Компрессор 3, отсасывая образовавшиеся пары хладагента, сжимает их до давления, чуть большего, чем давление в конденсаторе, и выталкивает в конденсатор. Сжатые горячие пары холодильного агента, попавшие в конденсатор, охлаждаются водой или воздухом и конденсируются. Жидкий холодильный агент вновь направляется к регулирующему вентилю 1, после чего весь процесс повторяется.
Чтобы сжать пары холодильного агента, необходимо затратить энергию в компрессоре q
km. Эта энергия вместе с теплотой, отводимой от объекта охлаждения q
к, передается окружающей среде в конденсаторе: q
к = q
км + q
о.
Температуры кипения холодильного агента t
о и конденсации t
к в установившемся режиме работы паровой компрессионной холодильной машины являются постоянными величинами и используются в холодильной технике в качестве основных технических показателей.
Технические характеристики холодильных машин и агрегатов, используемых для хранения цветочной продукции, приведены в таблице 23.

23. Технические характеристики холодильных машин и агрегатов
Освоен выпуск мобильной холодильной установки ФХ-80П с комплектом оборудования для охлаждения воздуха, которая предназначена для предварительного охлаждения свежего растительного сырья до температуры транспортировки в рефрижераторах или кратковременного хранения. Эта установка может быть использована в крупных цветоводческих хозяйствах в период массового цветения и срезки цветов, а также при сборе и временном хранении цветочного и эфирномасличного сырья перед отправкой его на переработку. Установка состоит из прицепа с холодильным агрегатом и прицепа с пневмосооружением и газодувкой. Она поставляется потребителям в полной заводской готовности.
Применяют также холодильную установку типа ПХУ18х2-1-0. Это установка непосредственного охлаждения, блочная, одноступенчатая. Состоит из двух бессальниковых компрессоров, воздушного конденсатора с двумя осевыми вентиляторами, ресиверов, воздухоохладителя с осевым вентилятором и шкафа управления.
Входящее в состав установки ФХ-80П пневмосооружение Вымпел-12 — надувное быстровозводимое пневмо-каркасное (в виде трех отдельно упакованных секций и тамбура) с газодувкой 14-21-30-А4. Имеются подъемник и щит управления. Весь комплекс монтируется на горизонтальной площадке с уплотненной поверхностью. Система автоматики обеспечивает автоматическое поддержание в нужных пределах температуры в помещении пневмосооружения и избыточного давления воздуха в его каркасе, а также защиту оборудования от аварийных режимов работы. Питание комплекса осуществляется от сети переменного тока или дизель-генератора напряжением 380 В, частотой 50 Гц. Холодопроизводительность установки 34,8 кВт, потребляемая мощность 39,7 кВт при температуре воздуха на входе в конденсатор t
в = 6 °C и на входе в воздухоохладитель t
в. вх = 30 °C. Электродвигатель газодувки типа 4А-90-А4 мощностью 1,65 кВт.
Для получения и автоматического поддержания в камере хранения необходимого температурного режима предназначена холодильно-нагревательная машина
ХМФ-32. Машина (одноступенчатая) состоит из компрессорно-конденсаторного и двух воздухоохладительных агрегатов, а также шкафа управления. Система автоматически обеспечивает поддержание необходимой температуры в камере, защиту от превышения нагнетаемого давления, автоматическое оттаивание снеговой шубы с поверхности воздухоохладителей парами хладагента и сигнализацию. Зимой температурный режим в камере поддерживается электронагревателями. Холодопроизводительность машины 37,2 кВт, потребляемая мощность 35,6 кВт при t
в. вх = 2 °C.
Холодильно-нагревательная машина типа ХМФ-16 имеет производительность по холоду 18,6 кВт, потребляемую мощность 18,2 кВт при температуре в камере 2 °C и температуре на входе в конденсатор 30 °C.
Перечисленные установки обеспечивают хранение продукции в камерах вместимостью от 50 до 200 т (Буряк, 1985).
Особого внимания цветоводческих хозяйств заслуживают разборно-сборные холодильные камеры. Они отвечают всем требованиям высококачественного автоматизированного сборно-разборного оборудования, обеспечивающего сохранность скоропортящейся продукции в различных температурных режимах.
Такие камеры монтируют на месте их установки из готовых теплоизоляционных щитов и оборудуют компактными холодильными агрегатами, поставляемыми заводом-изготовителем в комплекте камер.
По температурным режимам хранения камеры подразделяются на среднетемпературные и низкотемпературные. Последние имеют утолщенную изоляцию, дополнительные устройства для снижения потерь холода, а также систему удаления инея. Выпускаются и комбинированные камеры с низкотемпературным и средне-температурным отделениями.
Сравнительные характеристики сборных холодильных камер отечественного производства, применяемых для хранения цветочной продукции, представлены в таблице 24.

24. Технические характеристики сборных холодильных камер
Холодильная камера ЗКХР предусматривает возможность визуального контроля качества хранящейся продукции через специальную витрину, снабженную тремя рядами стекол. Камера при необходимости освещается тремя люминесцентными лампами для лучшего обзора цветов. Дверь с надежным запором и специальными прокладками обеспечивает достаточную герметизацию для сохранения стабильной температуры хранения.
Холодильные камеры для цветов существенно отличаются от камер для пищевых продуктов как по размерам, так и по конструкции. Во-первых, внутри камер поддерживается более высокая температура (до 12–14 °C). Во-вторых, в конструкции этих камер используют щитовые сборные элементы с меньшей толщиной термоизоляции — 30–50 мм по сравнению с 60–70 мм у камер для пищевых продуктов. В-третьих, камеры для цветов имеют большую площадь наружного остекления, что позволяет не только хранить, но и демонстрировать цветочную продукцию.
Влажность воздуха поддерживают на высоком уровне для предотвращения потери воды цветами во избежание снижения их тургора, а следовательно, и увядания.
Автоматика позволяет поддерживать стабильную заданную температуру с колебаниями ее не более 0,1 °C. Для нейтрализации этилена и этиленообразующих компонентов предусмотрено использование активированного угля и других адсорбирующих веществ.
В промышленном цветоводстве Голландии для хранения срезанных цветов применяют сборные камеры с двухслойной термоизоляцией типа «сэндвич»: 12–14 см толщина полистирола и 10–12 см — полиуретана (Дамен, 1980). Камеры выполняют двухсекционными, где одна из секций служит для предварительного охлаждения. Эта система отличается большими возможностями регулирования режима при обеспечении равномерной температуры воздуха и высокой относительной влажности во всем объеме камеры.
Аналогичные камеры используют в Италии. Их снабжают навесными холодильными агрегатами, позволяющими поддерживать температуру в диапазоне от —10 до 45 °C в камерах вместимостью 4,5—500 м
3. Тип холодильного агента R12.
Практика промышленного цветоводства показывает, что применение холода при хранении цветочной продукции позволяет сократить ее потери, снять пиковые нагрузки в хозяйствах в период массового цветения и равномерно в течение года обеспечивать спрос населения на цветы.
ТЕХНИЧЕСКИЕ СРЕДСТВА ХРАНЕНИЯ ЦВЕТОЧНОЙ ПРОДУКЦИИ В РЕГУЛИРУЕМОЙ ГАЗОВОЙ СРЕДЕ
За годы развития способа хранения растительной продукции в регулируемой газовой среде постоянно модернизировались и совершенствовались технические средства, обеспечивающие применение метода.
Работы в этой области ведутся в двух направлениях: создание техники для хранения продукции в трехкомпонентной газовой смеси (кислород, азот и углекислый газ); техническое обеспечение хранения продукции в двухкомпонентной газовой смеси (азот и кислород). В настоящее время в промышленных масштабах применяется хранение в РГС трехкомпонентного состава.
Хранение в РГС предусматривает обязательное использование холода, сочетание которого с оптимальным температурно-влажностным режимом позволяет резко сократить потери продукции. Холодильные установки для камер с РГС принципиально не отличаются от обычных, предназначенных для хранения продукции без РГС. Однако эти установки должны иметь большую надежность, повышенную степень герметичности и автоматизации, обеспечивать более точное и плавное регулирование температурно-влажностного режима в камерах (Янюк, 1984).
Для создания холода при хранении в РГС обычно используют насосно-циркуляционные или безнасосные системы непосредственного охлаждения, дающие возможность отдельно регулировать температуру кипения в каждой камере или группе камер с одинаковыми режимами хранения. Автоматика предусматривает ступенчатое регулирование холодопроизводительности и кратности циркуляции газовой среды путем управления работой компрессоров и воздухоохладителей за счет системы воздухораспределения. Это позволяет снизить мощности холодильных установок и уменьшить осушку воздуха при переходе с режима предварительного охлаждения камер на режим длительного хранения.
Для промышленного хранения цветов при децентрализованном охлаждении рекомендуется использовать автономные фреоновые машины типа ХМФ-32 и другие, состоящие из двух разделительных блоков — компрессорно-конденсаторного и испарительного. Такое разделение облегчает задачу герметизации ограждений камер, у которых монтируется холодильное оборудование.
Температурно-влажностные режимы в камерах с РГС обычно поддерживают с помощью воздушной системы охлаждения, что позволяет обеспечить равномерные газовый состав среды, температуру и влажность по всему объему камер.
Воздухоохладители, размещаемые в камерах, могут быть напольными или подвесными. Последние обычно применяют для камер с большой высотой потолков. Камеры такого типа необходимо снабжать нагнетательными трубками для выпуска газовой смеси под потолком. Напольные воздухоохладители проще в монтаже и установке, так как они не связаны с ограждающими конструкциями камеры и не нарушают ее газоизоляционного слоя.
При любом типе воздухоохладителя эффективно использовать бесканальное распределение газовой смеси по объему камер. Газовая смесь должна равномерно циркулировать, причем скорость ее вокруг продукции должна быть минимальной (0,2 м/с) и достаточно большой в батарее воздухоохладителя (3–5 м/с). Оптимальная кратность циркуляции газовой смеси в камерах в период поддержания стационарного режима хранения — 10–20 объемов незагруженной камеры в час. Температурный напор между газовой смесью в камере и хладагентом в воздухоохладителях не должен быть выше 6–8 °C в период охлаждения продукции и 3–4 °C при хранении, а разность температур на входе и выходе газовой смеси из воздухоохладителя соответственно 3–4 и 1–2 °C. В ориентировочных расчетах холодопроизводительность воздухоохладителей камер с РГС принимают равной 25–35 Вт на 1 м
3 камеры при единовременной загрузке не более 10 % ее вместимости.
С учетом того что доступ в камеру с РГС ограничен, требованиям и повышенной эффективности и надежности должна отвечать система оттаивания воздухоохладителей. Идеальная система оттаивания — автоматическая с возвратом влаги в камеру путем сублимации снеговой шубы. Для предотвращения разгерметизации камер талую воду после оттаивания необходимо отводить через гидрозатворы с контролируемым уровнем воды в них. Во избежание попадания избытка капельной влаги с потолочных конструкций на продукцию рекомендуется изоляция поддонов воздухоохладителей и их трубопроводов термопластом типа ПСБ-С толщиной до 50 мм.
Запрещается размещать в камере какие-либо вентили или регулировочные устройства, так как их обслуживание связано с разгерметизацией камеры для входа оператора. Надзор за
работой системы вентиляции внутри камеры можно вести через смотровое окно по подвижности индикаторных лент, обдуваемых циркулирующей газовой смесью. При необходимости обогрева камер в зимнее время применяют электрокалориферы, вмонтированные в воздухоохладители или специальные калориферы.
Оптимальное для каждого вида хранящейся продукции соотношение между концентрацией кислорода и углекислого газа в камере с РГС поддерживают несколькими способами:
путем замены части газовой среды камеры на наружную (естественное формирование газовой среды, характерное для нормальных газовых смесей);
удалением избытка углекислого газа с помощью специальных скруббирующих устройств с абсорбционными или адсорбционными поглотителями углекислого газа (естественное формирование газовой среды, субнормальные газовые смеси);
заменой части газовой среды камеры на приготовленную в специальных установках-генераторах (искусственное формирование газовой среды, субнормальные газовые смеси);
путем газообмена внутренней среды камеры с наружной атмосферой через диффузионные газообменные, газоразделительные устройства из селиктивно-проницаемых для компонентов газовой среды материалов (естественное формирование газовой среды, субнормальные и нормальные газовые смеси).
В соответствии со способами формирования газовых сред холодильные камеры с РГС подразделяют на виды:
герметичные с ограждениями высокой плотности, в которых газообмен через поверхности ограждений настолько мал, что за счет физиологической активности продукции можно создать и поддерживать на необходимом уровне концентрацию кислорода и углекислого газа;
герметичные с ограждениями пониженной плотности, в которых стабилизация и сохранение требуемого режима достигаются только искусственным путем за счет подачи газовой среды определенного состава из внешних источников (генераторы, азотные установки, баллоны, емкости и т. д.).
Регулирование концентрации углекислого газа при естественном образовании газовых смесей в камерах с высокой степенью герметизации обычно проводят при помощи скрубберов — аппаратов, в которых избыток углекислого газа из газовой смеси поглощается абсорбцией его или адсорбцией химическими или физическими поглотителями. Для поглощения углекислого газа в скрубберах используют активные угли, молекулярные сита, поташ, растворы этаноламина и т. д.
Скруббирующие установки работают по централизованной схеме (группа камер — скруббер — группа камер) Или по децентрализованной (камера — скруббер — камера). Наиболее широко применяются двухсекционные скрубберы непрерывного действия, работающие по децентрализованной схеме (рис. 23). В установке одновременно происходят два процесса. В одной из секций поглощается углекислый газ, в другой — поглотитель регенерируется атмосферным воздухом. Секции попеременно переключаются с режима поглощения на режим регенерации с помощью автоматических четырехходовых клапанов.
Рис. 23. Схема скруббйрующей установки для поглощения углекислого газа с естественным формированием газовых сред: 1 — вентилятор газовой смеси; 2 — вентилятор для регенерации; 3 — автоматические клапаны; 4 — двухсекционный адсорбер С0sub2/sub
Установлено, что при стандартном газовом режиме в герметичной холодильной камере концентрация углекислого газа в результате дыхания растительной продукции возрастает за сутки на 1–1,5 % свободного объема камеры. Продолжительность вывода камеры на заданный режим зависит от реальных условий работы установки и вместимости камеры. При этом желательно, чтобы указанное время не превышало продолжительности односменной работы. Обычно в практике промышленного хранения продукции время вывода на режим хранения составляет от 5 до 24 ч (Семашко, 1984).
В нашей стране и за рубежом в качестве автономных скруббирующих установок чаще всего используют аппараты очистки, входящие в состав генераторов газовых сред, выполненные в виде самостоятельных блоков.
В СССР выпускают аппарат очистки А02Б и некоторые другие, в США — аппарат марки «Аркосорб». Из автономных скруббирующих установок можно отметить аппараты серии «Джем» (Италия), «Стал-Астра» (ФРГ), в которых основным поглотителем служит активированный уголь, обеспечивающий попеременно адсорбцию — регенерацию.
Помимо скруббирующих аппаратов с физическими поглотителями, за рубежом используют аппараты абсорбционного типа (мокрые скрубберы), работающие на непрерывно регенерируемом химическом поглотителе углекислого газа в виде водных растворов, например этаноламинов и др. Регенерация поглотителя осуществляется нагреванием раствора или продувкой через него атмосферного воздуха. К установкам такого типа относятся аппараты очистки «Халл» (Италия), «Зульцер» (Швейцария) и др.
Для создания и поддержания газовых сред в камерах с ограждениями пониженной плотности обычно применяют специальные генераторы газовых сред. С их помощью получают газовые смеси путем сжигания или каталитического окисления углеводородного топлива. Эти смеси отличаются повышенным по сравнению с обычным воздухом содержанием углекислого газа и пониженным — кислорода. Смесь необходимого состава для хранения продукции в камерах получают после очистки продуктов сгорания от избытка С02 и охлаждения. При сжигании газов в воздушной среде получаемой газовой смесью постепенно замещают среду камер. Генераторы с таким принципом получения сред относятся к установкам проточного типа. Работают они по открытой схеме атмосфера — генератор — камера — атмосфера (рис. 24).

Рис. 24. Схемы установки для искусственного образования газовых сред с генератором проточного типа (а) и генератором рециркуляционного типа (б): 1 — баллон для сжиженного газа; 2 — воздуходувка (вентилятор); 3 — реактор (горелка); 4 — промежуточный охладитель; 5 — катализатор; 6 — охладитель; 7 — теплообменник; 8 — электронагреватель
При использовании в качестве среды для сжигания горючих газов внутренней атмосферы камеры газовая среда отбирается из камеры, избыток кислорода в ней «выжигается», и очищенная среда подается обратно в камеру. Подобные генераторы относятся к установкам рециркуляционного типа. Они работают по замкнутой схеме камера — генератор — камера. В таких генераторах применяют только специальные каталитические горелки, в которых можно сжигать горючие газы в среде с низкой концентрацией кислорода. Получаемые продукты сгорания охлаждают водой до 10–25 °C в обменниках-холодильниках, встроенных в генератор.
Обычно в состав установок генерирования газовых сред включают и блок очистки (скруббер) для полного или частичного снижения концентрации углекислого газа. Блок очистки либо встраивается в генератор, либо придается к нему в автономном виде.
Существенное преимущество камер, оборудованных генераторами, заключается в быстроте создания газовых сред необходимого состава, что позволяет увеличить сроки хранения продукции при стабильном высоком ее качестве. Зарубежные специалисты считают, что при прочих равных условиях вывод камер на заданный режим в течение 1–4 суток против 14–20 суток увеличивает срок хранения продукции в РГС примерно в 1,2 раза.
При использовании генераторов газовых сред снижаются требования к герметичности ограждений, что позволяет быстрее и с меньшими затратами проводить переоборудование холодильных камер обычного хранения в камеры с РГС.
К комплексным установкам, выпускаемым в СССР для организации хранения продукции в РГС, относятся: установка УРГС2Б с генератором проточного типа и рециркуляционная генераторная установка газовых сред РГГС-400.
В последние годы в нашей стране и за рубежом ведутся работы по созданию и использованию для холодильных камер с РГС установок и устройств, регулирующих газовые среды, использование которых не связано с потреблением горючих газов и не требует строительства станций газовых сред с системой газоснабжения. Такое естественное формирование газовых сред можно обеспечить с помощью диффузионных газообменных и газоразделительных устройств. Принцип работы этих устройств основан на селективной диффузии газов через высокопроницаемые полимерные или силиконово-каучуковые мембраны. Циркуляция газовой среды камеры через многокомпонентные диффузионные элементы, объединенные коллекторами, вызывает избирательный газообмен с окружающей средой, вследствие которого внутри камеры создается атмосфера необходимого газового состава. Подобные устройства обычно работают по схеме камера — диффузионный аппарат — камера.
Преимущества этих устройств по сравнению с генераторами заключаются в малом энергетическом расходе, простоте обслуживания и безопасности эксплуатации, а также в отсутствии потребности в горючих газах. Из недостатков следует отметить зависимость от интенсивности формирования продукцией газовой среды естественным путем в процессе дыхания, с чем связана невозможность ускоренного вывода камеры на стационарный режим хранения.
Наибольшее распространение диффузионные газообменные установки для холодильных камер с РГС получили во Франции, число их в настоящее время превысило 300. Эти установки применяют также в США, Италии и других странах.
В нашей стране аналогичный принцип создания и поддержания РГС в холодильных камерах с продукцией положен в основу установки «Барс». Установка позволяет раздельно регулировать концентрацию кислорода и углекислого газа и ускорять выход на заданный режим при использовании диффузионных мембран из полимерных материалов с избирательной, проницаемостью. В установку «Барс» входят: блок азотного снабжения, вакуумный насос, центробежный и осевые вентиляторы, система трубопроводов, запорная и регулирующая арматура, приборы контроля газовой среды и работы оборудования.
С помощью блока азотного снабжения, в котором имеется центральный разделительный аппарат, получают газовую смесь с концентрацией азота 96 %. Эту смесь по трубопроводу подают в любую из камер для хранения продукции в РГС. Поступая в камеру, азот вытесняет из нее воздух, удаляемый по отводному каналу в атмосферу. Это позволяет быстро вывести камеру на режим хранения.
Заданный состав газовой среды в камерах поддерживается блоками автоматического регулирования — газообменниками. Каждая камера имеет отдельный блок, который состоит из мембранного газоразделительиого аппарата, осевых вентиляторов, регулирующей и запорной аппаратуры и трубопроводов.
Как уже отмечалось, работа подобного газообменника основана на методе мембранного разделения газовых смесей. Разделение обеспечивается вследствие различных скоростей проникновения молекул разных газов через разделительную мембрану в результате перепада парциальных давлений. Верхний и нижний пределы концентраций газов задаются и могут изменяться в зависимости от вида хранящейся продукции: кислорода от 3 до 10 %, углекислого газа от 4 до 10 %. Через газообменник избыток углекислого газа удаляется, а газовая смесь обогащается кислородом из воздуха. Кроме газообменника, удалению углекислого газа способствует блок вакуумных насосов.
Рассмотренные выше технические средства хранения в РГС приемлемы только для крупных специализированных цветоводческих хозяйств и недоступны более мелким хозяйствам.
К альтернативным средствам технического обеспечения технологии хранения цветочной продукции во всех типах цветоводческих хозяйств относятся простые и доступные устройства и установки, создающие в замкнутом объеме камеры, контейнера, упаковки модифицированную газовую среду, обедненную кислородом и обогащенную углекислым газом.
В основу подобных устройств и установок заложен принцип избирательной проницаемости для кислорода и углекислого газа газоселективных элементов мембранного типа или самого материала контейнера-упаковки случае использования тонких полимерных пленок.
ТЕХНИЧЕСКИЕ СРЕДСТВА ХРАНЕНИЯ ЦВЕТОЧНОЙ ПРОДУКЦИИ В МОДИФИЦИРОВАННОЙ ГАЗОВОЙ СРЕДЕ
Простейшим техническим средством хранения цветочной продукции в MFC служат тонкие (30–60 мм) полимерные пленки, обладающие избирательной проницаемостью для основных газовых компонентов МГС: кислорода, углекислого газа и азота. Они обеспечивают увеличение срока сохранности цветочной продукции в 2–3 раза по сравнению с традиционными методами хранения, однако не находят широкого применения из-за дефицитности тонкопленочных материалов и малой их механической прочности.
Отмеченные недостатки отсутствуют в полимерных контейнерах и упаковках, снабженных газоселективными элементами мембранного типа (ГСЭМТ). Обычно в этом качестве используют мембраны с избирательной проницаемостью (СППМ) по кислороду и углекислому газу. При этом для самого мягкого контейнера-упаковки применяется полиэтиленовая пленка толщиной не менее 100–200 мкм, проницаемость которой близка к нулю.
Для хранения плодоовощной продукции за рубежом используют разработанный Р. Марселеном мягкий полиэтиленовый контейнер типа АС-500 вместимостью до 600 кг, снабженный ГСЭМТ в виде окна из силиконового эластомера. Общий вид и порядок загрузки подобного контейнера приведены на рисунке 25.

Рис. 25. Общий вид (а) и схема загрузки (б) контейнера АС-500: 1 — контейнер; 2 — зажим; 3 — мембрана; 4 — поддон; 5 — ящики с продукцией
Для хранения зеленных культур, нежных плодов и овощей применяют также мягкие пленчатые контейнеры с ГСЭМТ вместимостью 10–20 кг, закладываемые с продукцией в стандартные перфорированные коробки из гофрированного картона (Tassot, 1979). К модификации таких контейнеров относится короб с крышкой, снабженный ГСЭМТ (рис. 26).

Рис. 26. Коробчатый контейнер с пленочным вкладышем и ГСЭМТ (а), короб с крышкой и ГСЭМТ (б): 1 — зажим; 2 — коробка; 3 — перфорация; 4 — ГСЭМТ (мембрана); 5 — крышка; 6 — короб
В подобных контейнерах возможно хранение и некоторых видов цветочной продукции, прошедшей предварительное охлаждение до температуры хранения в течение не менее 4 ч.
Конструкция контейнера позволяет поддерживать внутри него 100 %-ную относительную влажность воздуха при температуре хранения продукции в диапазоне от от 0 до 8 °C. Для зарубежных контейнеров подобного типа характерно соотношение площади ГСЭМТ к внутреннему объему контейнера 0,1–0,25 м
2 на 1 м
3, ГСЭМТ предтавляет собой мембранное «окно» из силиконового эластомера толщиной от 50 до 150 мкм.
Из отечественных разработок контейнеров для хранения продукции в МГС можно отметить контейнеры, аналогичные зарубежным АС-500 (вместимостью 500 т продукции) с ГСЭМТ из силиконово-каучукового эластомера на тканевой основе площадью 0,31 м
2.
Выпускаются мягкие полиэтиленовые контейнеры-вкладыши для ящиков вместимостью до 25 кг плодоовощной продукции; ГСЭМТ изготавливают из полимерных газоселективных пленок отечественного производства различного типа.
Данные контейнеры, параметры которых рассчитаны в соответствии с требованиями цветочной продукции, могут быть пригодны для ее хранения. Следует отметить, что при использовании мягких пленочных контейнеров-вкладышей необходимо применять пластмассовую или картонную тару во избежание механических повреждений вкладыша.
В последнее время разработаны различные типы мягких пленочных контейнеров с ГСЭМТ для хранения плодоовощной и цветочной продукции (Рукавишников, 1977, 1982; Никитаев, 1980; Стрельцов, 1982, 1983), которые позволяют продлить на 2–3 месяца (по сравнению с традиционным холодильным способом) срок хранения заложенной в них продукции с сохранением товарного качества. Для цветочной продукции рекомендуемый диапазон температур хранения составляет 1–6 °C. В зависимости от вида и массы продукции, а также параметров ГСЭМТ в контейнерах можно обеспечить содержание кислорода 3—18 %, углекислого газа 1—10 %, остальное азот.
Крупномерный мягкий контейнер, предназначенный для хранения значительного количества цветочной продукции (например, до 100 кг луковиц), представляет собой мешок из ориентированной полиэтиленовой пленки с внутренним расположением ГСЭМТ специальной секционной конструкции (рис. 27). Герметизацию горловины осуществляют разными запорными устройствами или тугой перезязкой. После герметизации горловины заложенная на хранение продукция через ГСЭМТ и воздушный канал в процессе дыхания сообщается с атмосферой, создавая в контейнере оптимальную газовую среду.

Рис. 27. Мягкий контейнер с внутренним расположением ГСЭМТ секционного типа: 1 — контейнер; 2 — ГСЭМТ; 3 — узел крепления ГСЭМТ; 4 — воздушный канал
Более доступны и просты для применения в цветоводческих хозяйствах мягкие контейнеры-вкладыши, рассчитанные на стандартную картонную тару и снабжаемые различными ГСЭМТ (рис. 28). После помещения контейнера-вкладыша с ГСЭМТ в коробчатую тару в него закладывают определенное количество цветочной продукции. Затем горловину его герметизируют и упакованную продукцию отправляют на хранение.

Рис. 28. Схемы упаковки срезанных цветов с применением вклеенных ГСЭМТ (а) и трубчатого ГСЭМТ (б): 1 — коробчатая тара; 2 — мягкий контейнер-вкладыш; 3 — замок; 4 — цветочная продукция; 5 и 6 — вклеенные ГСЭМТ (соответственно σ≈4,5 и а σ≈1); 7 — трубчатый ГСЭМТ
Экономически выгоден способ хранения цветов и черенков, предварительно помещенных в ящики, которые затем размещают в крупномерных пленочных контейнерах — упаковках или покрывают накидками с ГСЭМТ (см. главу 4).
Для хозяйств с небольшими объемами хранения цветов и черенков можно рекомендовать малогабаритные пленочные упаковки с ГСЭМТ (рис. 29), а также затворы типа СКАН для стеклянных банок (рис. 30).

Рис. 29. Схема упаковки для хранения и транспортировки цветов (а) и черенков (б) в МГС: 1 — зажим; 2 — пленочная упаковка; 3 — срезанные цветы; 4 — ГСЭМТ; 5 — место герметизации; 6 — черенки
Такие упаковки просты и доступны в изготовлении. Для них используют полиэтиленовую пленку толщиной 150–200 мкм (рукавную или полотно). Полиэтиленовая пленка устойчива к воде, достаточно прочна, химически стойка, биологически инертна и газонепроницаема (при указанной толщине). Эти свойства позволяют применять ее в качестве пленочной упаковки.

Рис. 30. Использование ГСЭМТ типа СКАН в сочетании со стеклянной банкой (а) и улучшенный вариант ГСЭМТ типа СКАН с фильтром-поглотителем (б): 1 — корпус крышки; 2 — мембрана; 3 — решетка; 4 — банка; 5 — продукция; 6 — фильтр-поглотитель
Закрепление газоселективной мембраны в «окне» упаковки и герметизацию мест ее сопряжения с материалом упаковки проводят липкой пленкой типа «М» шириной 20 мм (для склеивания магнитофонных лент). Можно использовать для этих целей ленту полиэтиленовую с липким слоем марки «А» шириной 30 мм. Места склеивания предварительно обезжиривают. Эти же пленки применяют для ремонта упаковок. Сварку швов упаковки следует проводить через термостойкую пленку из фторопласта или полиэмидную. Можно сваривать упаковки и через целлофановую пленку или кальку. Надежность контакта и равномерность проварки швов обеспечиваются при подкладывании под объект сварки на ровной поверхности резиновой пластины толщиной 2–3 и шириной 50—100 мм. В цветоводческих хозяйствах сварку швов упаковки проводят электроприбором типа «Молния», при небольших объемах хранения для этой цели можно применять электропаяльник.
Для упаковок рекомендуется использовать отечественные газоселективные мембраны типа ПВТМС или МД-А1 (Тарасов, 1981; Гладков, 1983). В связи с тем что материал мембраны обладает малой механической прочностью на излом, следует избегать перегибов ГСЭМТ и касания острых предметов. Подобные пленочные упаковки с продукцией можно хранить в бытовом холодильнике, при аккуратном обращении их используют многократно. Перед каждой закладкой цветочной продукции внутренний объем упаковки необходимо ополаскивать дезинфицирующим раствором с последующим устранением избыточной влаги.
Складировать и хранить мягкие полимерные контейнеры и упаковки с ГСЭМТ следует осторожно — вдали от нагревательных приборов, не нарушая целостности упаковки.
Пластмассовые крышки-затворы типа СКАН предназначены для хранения свежей растительной, в том числе и цветочной, продукции в стеклянных банках вместимостью 1–3 л. При использовании специального переходного кольца эти крышки можно использовать и в качестве ГСЭМТ, монтируемых в горловину полимерных пленочных упаковок. В зависимости от конструктивных особенностей крышки-затвора и типа газоселективной мембраны с применением таких крышек хранят до 10 кг цветочной продукции, например луковиц и клубнелуковиц. Основные конструктивные элементы крышки-затвора типа СКАН: корпус с перфорацией в нижней его части, обеспечивающий герметизацию емкости с продукцией по периметру горловины, решетка предохранительная с перфорацией, защищающая мембрану от внешних механических повреждений, и газоселективная мембрана, монтируемая с уплотнением ее решеткой в месте соединения с корпусом (см. рис. 30, а).
В некоторых модификациях крышки-затвора предусмотрены одна или две кольцевые полиэтиленовые прокладки для большей герметизации всей конструкции.
Значительный интерес представляют крышки-затворы с фильтром-поглотителем (см. рис. 30,б), который адсорбирует этиленоподобные химические вещества, выделяемые заложенной на хранение продукцией. Одновременно с этим фильтр может выполнять роль и влагорегулятора. В качестве фильтра-поглотителя используют активированный уголь, ионообменные цеолиты на носителе с развитой активной поверхностью, гранулированный перлит и вермикулит с пропиткой марганцовокислым калием или бромом и др.
При укупорке продукции в стеклянную банку последняя должна быть чистой и сухой, без сколов горловины. Продукцию перед закладкой не следует мыть, она не должна иметь видимых следов порчи, повреждений и старения. Укупорку емкости проводят наложением крышки-затвора на горловину с нажимом до захлопывания крышки на горловине. Нельзя подвергать крышку-затвор тепловой обработке для облегчения укупоривания, так как это может привести к нарушению герметичности.
Промышленный выпуск в достаточном количестве разработанных в последние годы в нашей стране технических средств хранения продукции в МГС и обеспечение ими специализированных цветоводческих хозяйств позволят длительно и с высоким качеством хранить основные виды цветочной срезки и посадочного материала.
ТЕХНИЧЕСКИЕ СРЕДСТВА ГИПОБАРИЧЕСКОГО ХРАНЕНИЯ ЦВЕТОЧНОЙ ПРОДУКЦИИ
Для обеспечения хранения цветочной продукции при пониженном давлении за рубежом используют установку, показанную на рисунке 31.

Рис. 31. Установка для хранения цветочной продукции при пониженном давлении. Обозначения в тексте
Принцип работы установки заключается в следующем. Фильтрованный воздух из атмосферы, дозируемый с помощью регулятора давления 1, поступает в магистраль, где увлажняется до необходимого уровня путем подачи в него диспергированной воды через увлажнитель 2. Затем он попадает в вакуумированный объем 3 с продукцией, охлаждается холодильным агрегатом 4 и удаляется, насыщенный этиленом и другими газовыми компонентами, вызывающими старение цветов. Удаление воздуха происходит с помощью вакуумного насоса 5.
На рисунке 32 приведена схема первого в нашей стране гипобарического хранилища для длительного содержания срезанных цветов в условиях пониженного давления (Журавленко, 1984).

Рис. 32. Схема гипобарического хранилища: I — машинный зал; II — холодильная камера. 1 — щит управления и КИП; 2 — холодильная машина; 3 — вакуум-насос; 4 — увлажнитель воздуха; 5 — электроконтактный вакуумметр; 6 — испарители; 7 — баромодуль; 8 — термометр сопротивления; 9 — дверь баромодуля
Хранилище состоит из холодильной камеры, где находятся баромодули, и машинного зала с оборудованием. Охлаждается камера за счет испарителей, подвешенных к потолку.
Баромодуль, в котором непосредственно хранится срезка, представляет собой горизонтально установленный цилиндр (диаметр 2,2, длина 4 м) со сферическими днищами, в который вварен тамбур с герметичной дверью для загрузки и выгрузки цветов.
Системой трубопроводов баромодули связаны с вакуум-насосом. Давление в нужных пределах — (100±20) мм рт. ст., или (13,34=2,7) кПа поддерживается с помощью электроконтактного вакуумметра, управляющего работой насоса.
Последовательность работы такова. Холодильные машины доводят температуру в камере до заданного уровня (2 °C). В баромодуль загружают цветочную продукцию, двери закрываются. Включается вакуум-насос. Специальная установка подает к растениям увлажненный воздух (процесс регулируется вентилями). Из камеры удаляются летучие вещества, выделяемые растениями (этилен, углекислый газ и др.). Перед выгрузкой цветов давление в баромодуле уравнивают с атмосферой при помощи вентиля. Управление работой всего оборудования осуществляется автоматизированно с помощью контрольно-измерительной аппаратуры.
При эксплуатации хранилища можно вести периодический регламентный осмотр, который практикуется при обслуживании торгового холодильного оборудования.
Надзор за продукцией проводят визуально с интервалом 5—10 дней в баромодуле или с проверкой цветов на время сохранности декоративных качеств в вазе. Технологические опыты со срезанными гвоздиками, хризантемами, пионами, розами показали, что многократная (до 10 раз) разгерметизация баромодулей не влияет на качество растений.
Для реализации комбинированного метода хранения в холоде с предварительным вакуумным охлаждением цветочной продукции применяют различные модификации специальных камер и установок. По устройству и принципу вакуумного охлаждения установки отличаются друг от друга только типом используемых вакуумных насосов. Установки с применением пароструйного насоса предназначены для обработки продукции малыми партиями и могут быть использованы в цветоводческих хозяйствах с небольшим объемом продукции. Блок-схема такой установки показана на рисунке 33, а. Подобные установки дешевы и несложны в эксплуатации.

Рис. 33. Блок-схема установки вакуумного охлаждения (а) и схема получения озона при различном размещении электродов и диэлектрика в озонаторе (б): Э — электрод; П — воздушный зазор; Д — диэлектрик; Тр — трансформатор
К более сложным и энергоемким относятся универсальные установки для охлаждения всех видов свежей растительной продукции. Они представляют собой агрегаты, состоящие из вакуумного насоса с конденсатором и гидравлическим или масляным уплотнением или насосы со встроенным конденсатором.
ЭЛЕКТРОФИЗИЧЕСКАЯ ТЕХНИКА ДЛЯ ХРАНЕНИЯ ЦВЕТОЧНОЙ ПРОДУКЦИИ
Технические средства для применения электрофизических методов обработки цветочной продукции в целях ее хранения включают в себя источники озона, аэроионов, электромагнитной энергии и др.
Озон — основной активный агент аэроозонной газовой смеси, используемой для обработки цветочной продукции. Вырабатывается он в электрофизических устройствах и установках — озонаторах (Филиппов, 1980).
Основной метод получения озона — электросинтез его из воздуха в зоне «тихого» (барьерного) разряда. Такого вида высоковольтный разряд создается в воздушном зазоре между двумя электродами, из которых один или оба покрыты диэлектриком. Простейшая схема получения озона в межэлектродном пространстве озонатора при различном размещении электродов и диэлектрика дана на рисунке 33, б.
Между диэлектриком Д и противоположным электродом или между обоими диэлектриками остается воздушный зазор П (разрядный промежуток) величиной 1–3 мм. При продувании воздуха или кислорода через разрядный промежуток и при подаче через трансформатор к электродам переменного тока высокого напряжения (10–20 кВ) в разрядном промежутке возникает разряд, в котором происходит синтез озона из кислорода.
Производительность озонатора зивисит от многих факторов: напряжения, частоты тока, материала диэлектрика, влажности, расхода продуваемого воздуха, охлаждения электродов и др.
Мощность озонатора можно увеличить при постоянстве его габаритов повышением частоты питающего тока. Переход с промышленной частоты (50 Гц) на частоту, например 2–3 кГц позволяет заменить одним высокочастотным озонатором около 60 аналогичных по мощности низкочастотных.
Так как в процессе синтеза озона происходит и его распад, то увеличение скорости подачи в разрядный промежуток обрабатываемого газа одновременно повышает выход озона, но и уменьшает его содержание в газовой смеси. Эти процессы взаимосвязаны, и на практике подбирают их оптимальные соотношения. Концентрацию озона в смеси на выходе озонатора можно увеличить путем снижения скорости прокачки обрабатываемого газа. При необходимости иметь невысокие концентрации озона, но высокую производительность озонатора увеличивают скорость прокачки обрабатываемого газа.
В связи с тем что озон при повышении температуры интенсивно разлагается, для увеличения мощности и производительности озонатора необходимо охлаждать нагревающиеся в процессе работы электроды.
Электрозарядные генераторы озона выпускаются промышленностью как у нас в стране, так и за рубежом в основном в виде экономичных трубчатых коаксиальных конструкций.
Для цветоводческих хозяйств можно рекомендовать озонатор «Озон-2М», в составе которого предусмотрен озономер типа «Озон-4» (технические характеристики озономера приведены в главе 8). Производительность озонатора «Озон-2М» — 30 г/ч, концентрация озона — до 30 мг/л, масса — 170 кг.
Более компактной конструкцией из двух настольных блоков является озонатор производительностью 10 г/ч с концентрацией озона до 5 мг/л, массой 70 кг.
Одна из последних отечественных разработок — переносной озонатор «Озон-12К», состоящий из блока дистанционного управления, регулирования и контроля режимов работы, снабженного регистратором производительности по озону в виде специального прибора. Генератор озона пластинчатый, с предварительной воздухоподготовкой, с вентилятором и высоковольтным трансформатором, скомпанован в самостоятельный блок. Основные технические характеристики озонатора «Озон-12К» следующие. Производительность по озону — 15+2 г/ч; расход воздуха на озонирование — 140+10 м
3/ч; номинальная концентрация озона при температуре от —35 до 5 °C — 0,1±0,02 г/м
3 и от 5 до 15 °C — 0,07 + 0,01 г/м
3, потребляемая мощность — 500 Вт; питание от сети переменного тока напряжением 220 В и частотой 50 Гц; масса пульта управления—18, блока выработки озона — 42 кг.
В пунктах реализиции цветов можно использовать малогабаритный озонатор «Пион-1,5», производительность которого 0,14 г/ч, концентрация озона — 1,5 мг/л; масса — 2,5 кг.
Для небольших цветоводческих хозяйств, а также для пунктов реализации цветов выпускается портативный аэроионизатор типа АИР-2. Он позволяет путем коронного разряда на остриях игольчатых электродов получить на расстоянии 150 мм степень ионизации до 5,4- Ю4 ион/см
3. Питание аэроионизатора осуществляется от сети переменного тока (220 В, 50 Гц).
К более мощным портативным аэроионизаторам относятся ионизаторы «Рязань» и «Рига». Они обеспечивают степень ионизации 3,6* 105 ион/см
3 на расстоянии 1 м.
ГЛАВА 8. КОНТРОЛЬНО-ИЗМЕРИТЕЛЬНАЯ АППАРАТУРА, ПРИМЕНЯЕМАЯ ПРИ ХРАНЕНИИ ЦВЕТОЧНОЙ ПРОДУКЦИИ
Успешное хранение цветов, семян, органов вегетативного размножения цветочных растений зависит от создания и поддержания на стабильном уровне необходимой среды в хранилище: температуры, влажности, газового состава. Для правильного расчета, проектирования и эксплуатации устройств, применяемых в определенной технологии хранения, необходимо располагать информацией как об условиях, существующих в хранилище, так и о свойствах сохраняемой цветочно-декоративной продукции, поскольку от нее в значительной степени будут зависеть параметры среды. Это особенно важно, когда хранение ведется в условиях МГС, создание и поддержание которой определяются метаболическими процессами в срезке, семенах, вегетативных органах цветочных культур.
ОПРЕДЕЛЕНИЕ ИНТЕНСИВНОСТИ ДЫХАНИЯ И ДЫХАТЕЛЬНОГО КОЭФФИЦИЕНТА ЦВЕТОЧНОЙ ПРОДУКЦИИ
Интенсивность дыхания принадлежит к числу основных показателей, используемых при расчете газового режима в хранилище и параметров мембран, создающих модифицированную газовую среду. Концентрация кислорода и углекислого газа, которую необходимо измерять, обычно находится в диапазоне 1—10 %. Целесообразно использовать самые простые приборы и методы, дающие вполне удовлетворительную точность для указанных концентраций.
Чтобы определить количество поглощенного кислорода и выделившегося углекислого газа, поступают следующим образом. Берут определенную навеску цветов (0,5 кг), выкладывают их на решетку вакуумного эксикатора и герметично закрывают крышкой. Через 16–17 ч отбирают две пробы газа на анализ содержания С0
2 и Ог с помощью прибора ГХЛ (газохимическая лаборатория). Затем рассчитывают величину дыхательного коэффициента и интенсивности дыхания исходя из содержания газовых компонентов в пробе воздуха, его объема в эксикаторе, массы, времени.
Такая методика, однако, не дает представления о динамике дыхания и требует слишком много времени для проведения анализа. Для определения интенсивности дыхания и дыхательного коэффициента более удобно использовать манометрические методы. Эти методы дают возможность измерять небольшие изменения количества кислорода при высоком (несколько процентов) его содержании в среде, а тем более при концентрации этого газа, соответствующей обычному состоянию воздуха. Манометрия позволяет одновременно регистрировать газообмен кислорода и углекислого газа, что крайне важно для соблюдения технологии хранения. Кроме того, в необходимых случаях легко проследить за дыхательным газообменом. Манометрические методы обладают большой чувствительностью, у них практически нет инерционности измерений. При этом используют небольшие навески материала и изменения газового состава регистрируют за короткие промежутки времени.
Различают два класса манометрических методов: открытая манометрия, при которой давление измеряют при постоянном объеме системы, и дифференциальная, при которой объем изменяется. Наибольший интерес представляет открытая манометрия, отличающаяся простотой и надежностью.
Схема способа открытой манометрии для определения интенсивности дыхания и дыхательного коэффициента показана на рисунке 34. Манометрическое определение проводят в закрытых сосудах с цветочной продукцией, где выделяющийся в процессе дыхания углекислый газ улавливается поглотителем. В качестве последнего можно использовать раствор щелочи (20 %-ный КОН) или поглотитель в твердой фазе — аскарит, размещаемый внутри сосуда в специальной емкости.
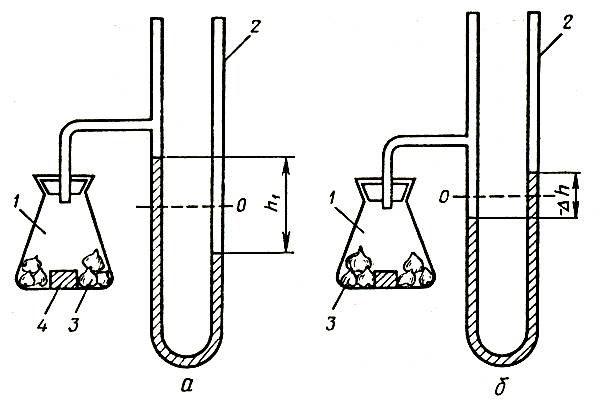
Рис. 34. Манометрический способ измерения дыхания и дыхательного коэффициента: 1 — сосуд с цветочной продукцией; 2 — водяной манометр; 3 — продукция (луковицы); 4 — поглотитель углекислого газа (аскарит)
Таким способом интенсивность дыхания оценивается по потреблению кислорода, снижение парциального давления которого регистрируется манометром, так как выделившийся углекислый газ полностью поглощается. Если проводят определение интенсивности дыхания срезки или черенков, содержащих хлорофилл, то измерение необходимо вести в темноте, поскольку при фотосинтезе газообмен направлен в противоположную сторону (поглощается углекислый газ, выделяется кислород). Для этого сосуд с дышащим растительным материалом накрывают плотной светонепроницаемой тканью или черной бумагой. На показаниях манометров могут отразиться колебания температуры окружающей среды, вследствие чего всю установку помещают в камеру с постоянной температурой, например в холодильную камеру хранилища.
Связь между изменением давления, регистрируемым манометром, и количеством выделившегося (поглощенного) газа устанавливается так называемым основным уравнением манометрии по О. А. Семихатовой:
У = hA, (21)
где V — количество поглощенного или выделившегося газа, м
3;
h отмеченное манометром изменение давления, обычно мм вод. ст.; А — константа манометрического сосуда, м
3/мм или м
3/Па.
Константа А учитывает в пропорциональной зависимости объем газовой фазы в манометрическом сосуде в зависимости от температуры среды плюс объем жидкого состава для поглощения выделившегося газа с поправкой на коэффициент растворимости газа в жидкости. Значение константы Л, кроме того, связано обратно пропорциональной зависимостью с нормальным давлением. Для практических расчетов следует принять во внимание, что в системе СИ 1 мм вод. ст. соответствует 9,81 Па. С учетом того что хранение обычно проводят при температурах, близких к 0 °C, а в качестве поглотителя выделившегося при дыхании продукции газа используют твердый аскарит, выражение для константы А можно записать в виде
А = V/P
o, (22)
где P
0 — нормальное давление (110
5 Па).
С учетом изложенного объем поглощенного (выделившегося) газа будет
V
r = 9,81hV
r/P
0, (23)
где V
r — объем газовой фазы в сосуде, м
3.
Согласно соотношению (1) для интенсивности дыхания, имеем:
К = 9,8110
-5V
rΔh/mΔt. (24)
Объем газовой фазы в сосуде равен разности между объемом сосуда V
с объемом цветочной продукции V
ц и поглотителя V
п, тогда
К = (9,8110
-5(V
c-V
ц-V
п)/m)•(Δh)/(Δt)
За немногими исключениями (одревесневшие черенки, совершенно сухие семена), можно считать, что масса растительного материала в граммах равна объему вытесненного газа в миллилитрах, поскольку срезка цветов, черенки, луковицы содержат значительное количество воды.
Определение дыхательного коэффициента проводят путем сопоставления двух манометрических измерений: падения давления при поглощении кислорода h
1 (см. рис. 34, а) и падения давления при поглощении кислорода и выделении в отсутствие поглотителя углекислого газа Δh = h
1 — h
2 (рис. 34, б). С учетом формулы (2) имеем:
δ = V
2/V
1 = h
2/h
1
Тогда, определяя изменение давления за счет выделения углекислого газа h
2 через Δh и h
1, получим
δ = (h
1 — Δh)/h
1
Если Δh = 0, дыхательный коэффициент равен 1, если происходит падение давления в отсутствие поглотителя (Δh>0), δ<1; если в отсутствие поглотителя давление повышается (Δh><0), δ>l.
Рассчитаем интенсивность дыхания клубнелуковиц гладиолуса сорта Оскар при температуре 5 °C. Согласно измерениям, оказалось, что за 15 мин давление в сосуде с 16 клубнелуковицами массой 0,615 кг понизилось на 53 мм. Объем сосуда 1,5 л, объем ванночки с аскаритом 0,1 л. Определим скорость падения давления:
В соответствии с (25) получим:
K = 9,8110
-5 (1,5•10
-3-0,615•10
-3-0,1•10
-3)]/0,615 = 5,9×10
-8м
3/кг•с.
Аналогично можно рассчитать интенсивность дыхания не только клубнелуковиц (луковиц), но и черенков, срезки, семян различных цветочно-декоративных растений. Величина интенсивности дыхания может изменяться с течением времени хранения или с изменением концентрации кислорода и углекислого газа.
В необходимых случаях можно повторно измерять интенсивность дыхания и получить кривую зависимости К = f(t). Характер такой зависимости содержит важную информацию об интенсивности метаболических процессов, происходящих в хранимом материале. Как правило, интенсивность дыхания в первый период хранения повышена и подвержена некоторым вариациям, но с течением времени она стабилизируется на более низком уровне. Измеренная величина начальной интенсивности дыхания может служить основой для соответствующих расчетов.
В том же эксперименте при удалении из ванночки аскарита наблюдалось в течение такого же времени некоторое повышение давления, равное 8 мм. С учетом этого в соответствии с (27) получим величину дыхательного коэффициента
δ = [53-(-8)]/53 = 1,16
При измерении интенсивности дыхания следует иметь в виду, что эта величина очень чувствительна к всяким механическим воздействиям на продукцию: повреждениям при неаккуратной закладке срезки или черенков в емкость для измерений, к скручиванию, складыванию или сдавливанию листьев, лепестков и т. д. Колебания температуры, влажности также могут быть источником погрешности, вследствие чего при однократном непродолжительном определении интенсивности дыхания возможно получение случайных недостоверных величин.
Определяя интенсивность дыхания в течение 1,5–2 ч, можно по характеру кривой К = f(t) судить о том, было ли повреждающее воздействие на продукцию, поскольку влияние этого воздействия обычно непродолжительно.
Кроме того, продолжительность опыта зависит от характера газообмена испытуемого материала; срезка дышит интенсивно, в то время как, например, семена имеют очень низкую интенсивность дыхания и необходимо большее время, для того чтобы в колене манометра произошло падение давления, поддающееся четкой и точной визуальной оценке. Величина этого перепада давлений зависит и от количества материала в измеряемом сосуде, его наполненности.
Для получения достоверных результатов необходимо также, чтобы скорость поглощения углекислого газа поглотителем была существенно больше скорости его выделения исследуемым объектом. Последнее условие обычно выполняется, если взять достаточное количество аскарита и равномерно распределить его в соответствующей емкости.
ИЗМЕРЕНИЕ ВОДНОГО ПОТЕНЦИАЛА И ТРАНСПИРАЦИИ СРЕЗАННЫХ ЦВЕТОВ
Декоративные качества
срезанных цветов во многом определяются состоянием их лепестков, а в некоторых случаях — листьев. Внешний вид как лепестков, так и листьев зависит от тургора в них, создание которого определяется водным потенциалом соответствующих растительных тканей, где запасы воды сосредоточены в основном в вакуолях. Вакуоль содержит значительное количество растворенных веществ, молекулы их ослабляют связь между молекулами воды, притягивая их к себе и уменьшая суммарный водный поток из клетки наружу. Концентрация растворенных в клетке веществ служит определенной мерой максимальной способности клетки поглощать воду, причем способность воды диффундировать, испаряться или поглощаться характеризуется водным потенциалом. Условно за нулевой потенциал принимают потенциал чистой воды при стандартных температурах и давлении и измеряют разность энергии молекул воды, находящихся в разных условиях. Чем ниже энергия молекул воды, тем ниже соответствующий водный потенциал. Поскольку нулевой потенциал имеет чистая вода, то с увеличением концентрации растворенных веществ потенциал снижается, становясь все более отрицательным. Молекулы воды перемещаются в направлении от более высокого к более низкому потенциалу, чем и объясняются осмотические явления водного режима растений. В водном потенциале выделяют составляющую, которую характеризует только присутствие растворенного вещества — так называемый осмотический потенциал. Он связан линейной зависимостью с концентрацией растворенного вещества. Моляльный раствор, содержащий 1 моль (грамм-молекулу) некоторого недиссоциируемого вещества (например, сахарозы), обладает остомотическим потенциалом 22,7 бар. Менее концентрированные растворы отличаются и меньшими значениями отрицательного потенциала. В любой момент времени водный потенциал клетки определяется разностью потенциалов давления (со стороны стенок) и осмотического потенциала. В дистиллированной воде клетка поглощает воду до тех пор, пока потенциалы давления и осмотический не сравняются.
Зная величину водного потенциала данной клетки, можно судить о том, как она будет вести себя по отношению к тому или иному раствору: поглощать из него воду или отдавать ее. На этом основан метод определения водного потенциала клетки путем погружения ее в ряд растворов сахарозы с постепенно возрастающей концентрацией. Водный потенциал того раствора, в котором не происходит изменения объема (или массы) клеток, будет равен величине клеточного потенциала.
Для быстрого определения водного потенциала срезки цветов, побегов, листьев или лепестков используют так называемую бомбу для измерения отрицательного давления (Гэлстон, 1983). При перерезке цветоноса или стебля натяжение воды в ксилеме устраняется и водный потенциал ксилемы, содержащий почти чистую воду (концентрация растворенных веществ невелика), падает практически до нуля. Клетки цветоноса, находившиеся в равновесии с ксилемой, поглощают дополнительное количество воды. За счет происходящего всасывания раствор, заполняющий сосуды ксилемы, несколько втягивается внутрь, отступая от краев среза.
Побег или цветонос помещают в толстостенный контейнер — бомбу, закрепляя его так, чтобы место срезки находилось снаружи и было доступно наблюдению (рис. 35). К бомбе присоединяют баллон со сжатым газом (обычно азотом) и постепенно повышают давление внутри нее, наблюдая за местом среза. Это внешнее давление вызывает увеличение потенциала давления клеток побега, приводящее к выдавливанию поглощенной воды назад в ксилему. Следя за этим процессом, отмечают момент, когда раствор, заполняющий сосуды ксилемы, появится на поверхности среза. Давление внутри бомбы в этот момент равно по величине, но противоположно по знаку давлению в ксилеме до перерезки стебля. Если бы сосуды ксилемы были заполнены абсолютно чистой водой, то измеренное давление точно соответствовало бы величине водного потенциала, но ксилемный сок содержит растворенные соли, концентрация которых, впрочем, невелика, в связи с чем невелика и соответствующая поправка.

Рис. 35. Бомба для измерения водного потенциала: 1 — корпус; 2 — побег; 3 — пробка; 4 — манометр
Этот метод позволяет легко и просто проводить измерения и сопоставительный анализ длительности жизни цветов в вазе, основываясь на измерении водного потенциала как срезки в целом, так и отдельных ее элементов (например, лепестков).
Принцип таких измерений был рассмотрен в главе 1.
Суммарный поток воды в растении направлен в сторону меньшего водного потенциала, который максимален в почве (или в вазе со срезкой цветов) и минимален в клетках эпидермиса листа или лепестка. Малая величина водного потенциала этих клеток связана с испарением воды, то есть с транспирацией. Скоростью удаления водяных паров с поверхности листьев при транспирации определяется интенсивность последней. Эта скорость зависит как от внешних условий, так и от свойств самого растения.
Когда воздух насыщен влагой, его водный потенциал равен нулю; чем меньше его относительная влажность, тем более отрицателен его водный потенциал. При снижении относительной влажности воздуха лишь на 1–2 % водный потенциал падает очень резко. При относительной влажности 50 % водный потенциал воздуха выражается отрицательной величиной — около нескольких сотен бар, в то время как в клетках листа он редко бывает ниже —20 бар. Вода из межклетников быстро диффундирует в более сухой атмосферный воздух. В солнечный день температура внутри листа может быть значительно выше, чем в окружающем воздухе, что усиливает транспирацию. Турбулентность воздуха также повышает транспирацию, так как быстрое удаление его из примыкающего к листу слоя приводит к увеличению скорости диффузии из листа в атмосферу.
Интенсивность транспирации проще всего определить, регистрируя потерю массы сосуда со срезкой, находящейся в воде. При этом сосуд должен быть герметизирован, чтобы изменения массы не были связаны с испарением непосредственно с поверхности воды. Замеряя потерю массы в течение определенного периода, можно построить кривую изменения транспирации, что весьма важно при изучении устойчивости цветов в вазе. Если уменьшение воды замеряют в единицах массы, то величина транспирации (кг/м
2с) определится следующим образом:
T = m/St (28)
где m — уменьшение массы воды (кг) в течение времени t, с; S — площадь листа, м
2.
Если уменьшение количества воды выразить в объемных единицах (м
3), то размерность транспирации изменится, м
3/м
2с:
T = V/St (29)
где V — объем испарившейся воды.
Интенсивность транспирации, то есть объем воды, выделенной побегом в единицу времени, можно определять с помощью прибора, называемого потометром. Простейший потометр (рис. 36, а) представляет собой градуированный цилиндр, заполненный водой или другим питательным раствором до определенной отметки. Срезку или побег погружают в жидкость так, чтобы листья и лепестки находились вне цилиндра. Цилиндр плотно закрывают пленкой, в отверстие которой проходит стебель, и измеряют скорость поглощения жидкости через установленные интервалы времени.
Потометр более точной системы (рис. 36, б) состоит из изогнутой трубки с отростком, который соединяется с резервуаром через кран. Резервуар служит источником воды для заполнения всей системы. Срезка укрепляется в вертикальной трубке и герметизируется резиновой пробкой. К горизонтальной трубке подсоединяется капилляр, вдоль которого закреплена шкала с делениями. Колено капиллярной трубки опущено в стакан с водой. Колено приподнимают, чтобы впустить пузырек воздуха, служащий в качестве метки, и вновь опускают в стакан. Систему полностью заполняют водой из резервуара, кран перекрывают. Если система герметизирована, вода в капиллярной трубке начинает двигаться, перемещая индикаторный пузырек вдоль шкалы. Когда пузырек доходит до конца шкалы, открывают кран, устройство заполняют водой, выпускают новый пузырек и проводят вторую серию измерений. Объем воды, выделенной побегом или срезкой в единицу времени, определяют, умножая длину пути, пройденного за это время пузырьком воздуха, на величину поперечного сечения капиллярной трубки.

Рис. 36. Потометры для измерения транспирации: 1 — побег; 2 — пробка; 3 — трубка; 4 — резервуар; 5 — кран; 6 — капилляр; 7 — пузырек воздуха; 8 — стакан
ГИДРАВЛИЧЕСКАЯ ПРОНИЦАЕМОСТЬ И КОЭФФИЦИЕНТ ПРОНИЦАЕМОСТИ СРЕЗАННЫХ ЦВЕТОВ
Сроки жизни в вазе существенно различаются у сортов декоративных растений даже одного и того же вида, что в значительной степени связано со строением сосудов ксилемы и их устойчивостью к действию различных факторов: микрофлоре, ферментам, закупорке вследствие разложения стенок и т. д. (см. главу 1).
Важно знать гидравлические параметры проводящих сосудов и их изменения за период жизни срезки в вазе. К числу таких параметров относятся гидравлическая проницаемость (или гидравлическое сопротивление) и коэффициент проницаемости. Первая величина характеризует стебель или его участок в целом, вторая — служит мерой проницаемости его сосудистой системы.

Рис. 37. Простейшее устройство для измерения гидравлической проницаемости: 1 — емкость для сбора жидкости; 2 — участок стебля; 3 — трубка; 4 — пробка; 5 — сосуд
На рисунке 37 представлено одно из простейших устройств для измерения проводимости участка стебля розы по Д. Дуркину. Водяная помпа обеспечивает разрежение около 20 мм рт. ст. (2,7 кПа), что вызывает передвижение воды через участок стебля розы длиной 37 мм. Замеряли количество воды (V, мл), прошедшее через стебель с поперечным сечением (S, мм
2) в течение 5 мин, и гидравлическую проницаемость (мл/мм
2мин) определяли соотношением
P' = V/S5
Перепад давлений поддерживали постоянным и равным 2,7 кПа. Полученные значения проводимости изменялись от 0,9 сразу после срезки до 0,05 на четвертый день жизни в вазе. Площадь сосудов ксилемы оценивали площадью одревесневшей части поперечного сечения стебля, за исключением серединной части, лишенной сосудов. Величина, определяемая соотношением (30), служит мерой гидравлической проницаемости. Более точно последнюю можно выразить следующим образом (м
3/сН):
Р = V/S
pt, (31)
где V — объем воды, м
3; р — перепад давления за время г, с.
Для рассматриваемого случая проводимость участка стебля длиной 37 мм будет
P = 0,9(10
-6м
3/(10
-4м
25•60с•20•10
5/760)) = 1,26•10
-8м
3/c•H
Коэффициент проницаемости связан с величиной проницаемости соотношением
K=PL (32)
где K — коэффициент проницаемости, м
4/(cН); L — длина участка стебля, м.
Для рассматриваемого случая К = 1,2610
-8•3,7•10= 4,66•10
-10 м
4/с•Н.
Другая, более совершенная система определения гидравлической проницаемости представлена на рисунке 38 (Sacalis, 1974). Здесь испытания проводят сразу на нескольких отрезках стебля, что дает возможность получать усредненные результаты при одном испытании. Кроме того, регулируя поднятие трубки, можно проводить испытания при различном давлении, определяемом высотой водного столба Н.

Рис. 38. Определение гидравлической проницаемости нескольких отрезков стебля: 1 — сосуд; 2 — трубка стабилизации напора; 3 — канал; 4 — черенки; 5 — воронка; 6 — емкость для сбора жидкости
ИЗМЕРЕНИЕ ВЛАЖНОСТИ И ТЕМПЕРАТУРЫ ВОЗДУХА В ХРАНИЛИЩЕ
Влажность и температура воздуха непосредственно влияют на интенсивность транспирации срезки, интенсивность дыхания, теплообмен с окружающей средой, а следовательно, и на сохранность цветочной продукции при сухом способе хранения срезки, а также хранении вегетативных органов и семян. Новые усовершенствованные хранилища должны быть оснащены аппаратурой контроля и регулирования микроклимата, чтобы свести к минимуму потери продукции.
Обычно содержание воды в воздухе принято характеризовать так называемой относительной влажностью, представляющей собой отношение фактической упругости водяного пара в воздухе к максимально возможной упругости водяного пара при данной температуре. Этим параметром выражается насыщенность воздуха водяным паром. В настоящее время выпускается несколько модификаций гигрометров и термогигрометров, которые пригодны для измерения влажности воздуха при хранении продукции.
Наиболее простой гигрометр основан на свойстве некоторых гигроскопических материалов изменять свои линейные параметры при сорбции атмосферной влаги. Чувствительным элементом таких гигрометров служит обезжиренный волос или пучок волос, удлиняющихся при повышении относительной влажности воздуха, отчего эти приборы называются волосными. Широкое распространение получил волосной метеорологический гигрометр MB-1, рабочий диапазон которого соответствует 30— 100 % относительной влажности. Выпускается также гигрограф, рабочий элемент которого животная пленка.
Такие сорбционно-дефракционные гигрометры отличаются простотой конструкции, легко градуируются, работоспособны в широком диапазоне влажностей, характерном для хранилищ с цветочной продукцией, стоимость их невелика. К недостаткам этих приборов относятся нестабильность работы и значительные погрешности измерений, доходящие до 7—15 % измеряемой величины, причем эта погрешность наиболее велика в том диапазоне (от —3 до +3 °C), который наиболее важно измерять при хранении цветочной продукции.
К числу традиционно используемых приборов для измерения влажности относятся психрометры, измерение влажности которыми основано на измерении температуры двумя термометрами — обыкновенным (сухим) и «мокрым» со смоченным водой фитилем, опущенным в небольшую емкость. Испарение с поверхности фитиля, обволакивающего конец с шарообразным утолщением, где помещается термическая жидкость (окрашенный спирт), вызывает понижение температуры тем большее, чем ниже влажность воздуха. По показаниям сухого и влажного термометров с помощью специальных психрометрических таблиц или графиков определяют относительную влажность воздуха.
На показания психрометров влияет скорость циркуляции воздуха. Поэтому аспирационные психрометры со стеклянными термометрами имеют электромотор с вентилятором, что обеспечивает стабильную скорость воздушного потока 3–4 м/с. Недостатки таких гигрометров — трудность измерения влажности даже при небольших отрицательных температурах. При температурах выше 0 °C эти психрометры дают стабильные показания, отличающиеся высокой точностью измерений. Вместо стеклянных жидкостных термометров могут применяться термопары или полупроводниковые термисторы.
Существуют гигрометры, измеряющие влажность на основе определения температуры, до которой необходимо охладить не насыщенный водяным паром воздух, чтобы довести его до состояния насыщения. В этом случае точка росы определяется по началу конденсации водяного пара на плоской поверхности твердого тела, охлаждаемой в атмосфере исследуемого влажного воздуха. Этот способ в связи с развитием метода термоэлектрического охлаждения получает большое распространение. Он дает возможность дистанционных измерений в широком диапазоне температуры и влажности. Однако практическое использование таких гигрометров связано с некоторыми трудностями. Результаты измерений зависят от состояния поверхности измерительного зеркальца — осаждающаяся пыль может резко ухудшить точность определения. Кроме того, необходимо иметь охлаждающее и фиксирующее точку росы устройства.
Пьезокварцевыми сорбционными гигрометрами влажность измеряют на основе анализа измерений параметров пьезокварцевого элемента при сорбции влаги его поверхностью. Обычно таким параметром является частота колебаний пластинки пьезоэлектрического материала с нанесенным на ее поверхность влагочувствительным веществом — пленкой цеолита, связанной термообработанным полиакрилнитрилом. Для измерения влажности в хранилищах такие приборы могут применяться лишь ограниченно, так как их рабочий диапазон охватывает температуры от 5 до 35 °C.
Кулонометрические гигрометры основаны на определении относительной влажности воздуха путем электролиза влаги, поглощенной специальным влагочувствительным элементом датчика. В качестве влагочувствительного материала используется фосфорный ангидрид. Приборы такого типа обладают высокой точностью измерений, но чувствительны к изменению температуры и давления, а также даже незначительному количеству примесей, реагирующих с веществом сорбента. Кулонометрические датчики не могут работать при высокой влажности, при которой возможно образование конденсата. Это делает их малопригодными для контроля влажности в хранилищах.
К числу наиболее пригодных для работы в холодильных камерах с продукцией, выделяющей влагу, относятся гигрометры, в качестве чувствительного элемента у которых применяется электрическое сопротивление, изменяющееся в зависимости от влажности (гигристор). При изменении влажности воздуха в пределах 35—100 % происходит значительное изменение сопротивления гигристора, обеспечивающее высокую чувствительность гигрометра к влажности. Это дает возможность использовать простейшие мостовые схемы на переменном токе, не прибегая к усилению сигнала. Шкала прибора градуируется в процентах относительной влажности воздуха. Серийно выпускается термогигрометр типа ТГ-70, который предназначен для измерения относительной влажности и температуры в различных помещениях сельскохозяйственного назначения, в том числе и в хранилищах. Предел измерения влажности 50—100 %, температуры — от —20 до 50 °C с погрешностью ±1 °C. Прибор имеет две шкалы — для влажности и для температуры. Термогигрометр может нормально работать в широком интервале давления воздуха. Измерительная схема прибора включает в себя мост переменного тока, терморезисторы ММТ-4 в качестве первичных преобразователей температуры. Конструктивно переносной термогигрометр состоит из датчика и измерительного блока, связанных кабелем. В датчике имеются первичные преобразователи влажности и температуры, расположенные в единой оправке, предохраняющей от механических воздействий, но обеспечивающей свободный доступ контролируемого воздуха.
Для регулирования температурного режима в хранилищах применяют дилатометрические и биметаллические датчики температуры. Эти датчики-реле выполняют роль управляющих элементов в различных системах автоматики или сигнализации (Беляев, 1985). Чувствительный элемент дилатометрических термодатчиков состоит из трубки, выполненной из металла с большим коэффициентом температурного линейного расширения (латунь, алюминий и др.), и находящегося внутри трубки металлического стержня с малым коэффициентом температурного расширения (например, из инвара). Трубку прибора полностью погружают в контролируемую среду. При изменении температуры среды изменяется длина трубки; связанный с ней стержень перемещается, в результате чего замыкаются (размыкаются) контакты или перемещается чувствительный элемент преобразователя (рис. 39, а).

Рис. 39. Дилатометрический (а), биметаллический (б) преобразователи температуры и термоэлектрический термометр (в): 1 — трубка из материала с большим коэффициентом температурного расширения; 2 — стержень из металла с малым коэффициентом температурного расширения; 3,4 — полоски металлов с разными коэффициентами температурного расширения; 5 — держатель подвижного контакта
В качестве чувствительного элемента в биметаллических преобразователях используется пластинка или спираль, состоящая из двух сваренных по всей длине металлических пластин с разными коэффициентами температурного линейного расширения (например, из меди и инвара). При изменении температуры среды биметаллическая пластинка (спираль) изгибается, перемещая чувствительный элемент преобразователя или переключая контакты (рис. 39, 6).
Различают термодатчики двухпозиционные типа ДТКБ (биметаллические) и типа ТУДЭ (дилатометрические), а также трехпозиционные типа ТБ-ЭЗК (биметаллические). Датчики-реле температуры камерные биметаллические трехпозиционные типа ТБ-ЭЗК применяют для автоматизации санитарно-технических устройств, систем вентиляции и кондиционирования, а также технологических процессов, связанных с поддержанием необходимой температуры воздуха в помещении.
Используют также термоэлектрические термометры. Действие их (первичных измерительных преобразователей) основано на использовании термоэлектрических явлений, возникающих в твердых телах в результате взаимодействия термоградиентных и электрических процессов. Так, в замкнутой цепи, состоящей из последовательно соединенных разнородных проводников, спаи которых поддерживают при разных температурах, возникают термоэлектродвижущие силы. Термопары обычно состоят из двух специально подобранных проволок (рис. 39, в), одни из которых спаяны, другие подключены к индикатору (чувствительному вольтметру). При нагревании спаянного конца образуется термоэлектродвижущая сила, пропорциональная разности температур между спаем и свободными концами.
Для измерений, проводимых при хранении цветов, пригоден серийно выпускаемый термоэлектрический термометр ТХА-0515, рабочий диапазон которого начинается с —50 °C. Прибор виброустойчив, постоянная времени, которой характеризуется тепловая инерция, составляет 10–40 с.
Другой широко распространенный датчик температур — термометр сопротивления, используемый для измерения температуры газообразных и жидких сред. Такие термометры часто применяют при измерении температуры воздуха в кондиционируемых помещениях.
Выпускаются стандартные и нестандартные термометры сопротивления с применением платиновой (ТСП) или медной (ТСМ) проволоки. Платиновыми термометрами сопротивления измеряют температуры в диапазоне от —260 до 1100 °C, медными от —50 до 180 °C. Металлический терморезистор изготовляется из тонкой проволоки, намотанной на электроизоляционный каркас, и закрывается защитным кожухом. Терморезистор медными выводами соединяют с электроизмерительным прибором и источником постоянного или переменного тока (Беляев, 1985). Чувствительный элемент медных термопреобразователей представляет собой бескаркасную безындукционную катушку (обмотку) из изолированной медной проволоки, покрытой фторопластовой пленкой. Для обеспечения механической и виброударной прочности катушка помещена в тонкостенную металлическую гильзу и засыпана ингибиторным керамическим порошком.
В хранилищах с цветочной продукцией можно применять термометры типа ТСМ-6114 с рабочим диапазоном от —50 до 100 °C, отличающиеся надежностью и долговечностью.
Сейчас распространены полупроводниковые терморезисторы с большим температурным коэффициентом электрического сопротивления (ТКС). Изменение величины электрического сопротивления терморезистора может быть вызвано изменением температуры окружающей среды; нагревом терморезистора электрическим током; одновременным воздействием обоих предыдущих факторов; изменением величины тока, протекающего по специальной подогревной обмотке, расположенной вблизи терморезистора, но электрически изолированной от него. Полупроводниковые терморезисторы сделаны из медно-марганцовых или кобальто-марганцовых полупроводниковых порошков со специальными добавками. Это позволяет изготавливать резисторы почти с любой величиной номинального сопротивления в пределах от 1 до 10 Ом. Для измерения температуры воздуха в хранилищах вполне пригодны терморезисторы типа СТ 1–2 с сопротивлением около 100 Ом. Температурный диапазон измерений такого терморезистора от —40 до 85 °C.
АНАЛИЗ ГАЗОВОГО СОСТАВА АТМОСФЕРЫ ХРАНИЛИЩА
Если цветочная продукция заложена на хранение в камеру с РГС, где устанавливается заданный газовый режим, то контроль газовых компонентов ведется автоматически системой соответствующей обратной связи.
В случае хранения в МГС на протяжении всего периода хранения цветочной продукции в пленочном контейнере с газообменным устройством должна быть стабильная температура в камере, чтобы суточные колебания ее не превышали 2 °C, а перепады за несколько месяцев хранения — не превышали 10 °C. Температура воздуха при хранении продукции должна быть постоянной, без резких колебаний. Режимы хранения в МГС поддерживают в пределах, предусмотренных технологией.
Для анализа газовых проб, отбираемых из упаковок с продукцией, целесообразно применять переносные газоанализаторы типа ГХП-ЗМ и ВТИ-2. Возможно применение других типов газоанализаторов с аналогичными измерительными характеристиками.
Газоанализатор ГХП-ЗМ предназначен для определения процентного содержания в газовой смеси отдельных компонентов: О
2, СО
2 и СО или непредельных углеводородов. Принцип действия газоанализатора основан на избирательном поглощении отдельных компонентов газов, О
2, СО
2, СО и др. соответствующими поглотительными растворами. Процентное содержание компонентов определяют по сокращению объема газовой смеси после поглощения одного из газов.
Отбор проб газа из упаковки проводят с помощью специального приспособления (рис. 40), состоящего из пипетки Зегера (1) на 100 мл, соединенной одним концом с резиновым шлангом (2), диаметром 6 мм и длиной 1000–1200 мм. Резиновый шланг сообщается с уравнительным сосудом (4)у заполненным насыщенным раствором поваренной соли. Второй конец пипетки Зегера соединяется при помощи резиновой трубочки длиной 70 — 100 мм с медицинской иглой для инъекций (?), причем хвостовая часть иглы должна быть круглой.

Рис. 40. Пробоотборник газа. Обозначения в тексте
Технология отбора проб газа состоит в следующем. Заполняют уравнительный сосуд насыщенным раствором поваренной соли при закрытых кранах пипетки, устанавливают вручную пипетку ниже уравнительного сосуда. Открывают краны в пипетке и заполняют ее раствором соли до вытекания последней из иглы непрерывной струей. Затем верхний кран пипетки закрывают. При заполнении пипетки насыщенным раствором ее необходимо держать в вертикальном положении, не допуская образования пузырьков воздуха. Перед взятием пробы газа из упаковки уравнительный сосуд располагают так, чтобы он был ниже уровня места отбора пробы на длину пипетки и иглы. К месту отбора пробы газа приклеивают кусочек липкой ленты длиной 10–15 мм и плавным движением руки вводят через нее иглу в упаковку так, чтобы конец иглы не повредил черенков. Открывают краны пипетки и заполняют ее газовой средой упаковки. Затем закрывают нижний кран, а через 5—10 с верхний, после чего снимают резиновый шланг с иглой. К поверхности пипетки прикрепляют с помощью резинового кольца или липкой ленты предварительно заготовленную бирку с указанием на ней номера ящика или контейнера, температуры камеры, даты взятия проб и вида продукции. Вынимают иглу из контейнера, очищают место прокола от капель раствора и заклеивают его липкой лентой. Далее проводят анализ состава газовой смеси по содержанию кислорода и углекислого газа на газоанализаторе или газовом хроматографе. Для более точного усредненного анализа проб газа из одной упаковки следует отобрать среду в объеме 2–3 пипеток Зегера.
Для контроля атмосферы хранилища в тех случаях, когда применяется электроаэроионизация воздуха, можно использовать универсальный счетчик аэроионов. Этот прибор прост в использовании и имеет широкие пределы измерения. Счетчик имеет самопишущий прибор и цифровой индикатор, обладает высокой эксплуатационной надежностью. Счетчик позволяет измерять до 30 предельных подвижностей аэроионов каждой из двух полярностей (отрицательной и положительной). Он имеет также до 30 диапазонов измерения по концентрациям аэроионов. Диапазон пределов измерения подвижностей аэроионов составляет от 0,00032 до 2 см
2/с, а концентрации — от 100 до 6,4-108 электрических зарядов на 1 см
3.
Для измерения концентрации озона в аэроозонной смеси в производственных условиях при хранении цветочной продукции рекомендуется использовать диэль-кометрический газоанализатор «Озон-4».
В зависимости от модификации озономер этого типа состоит из двух или трех настольных блоков, масса блока измерений 17 кг. Диапазон измерений концентриции озона составляет от 0 до 50 г/м
3 при погрешности не более ± 1,5 г/м
3.
При обработке цветочной продукции аэроозонной смесью с целью хранения в водной среде для измерения концентрации озона в воде используют автоматический анализатор 0-201. Работа этого прибора основана на измерении хемилюминесцентного свечения, возникающего при реакции растворенного в воде озона со специальным реактивом. Анализатор позволяет автоматически измерять концентрацию озона в воде в диапазоне от 0 до 1 мг/л при высокой степени чувствительности (0,0025 мг/л).
ПОСЛЕСЛОВИЕ
Целесообразно обратить внимание читателей на то, что не всегда следует ограничиваться лишь пунктуальным соблюдением тех или иных технологических режимов и рекомендаций. Поскольку речь идет о живых организмах, вряд ли можно рассчитывать на то, чтобы определенные правила, как бы хорошо они не были составлены, могли заменить живую практическую работу с растениями. В каждом отдельном случае возможны варианты технологии хранения, приспособленные к соответствующему виду и даже сорту декоративных культур, установление в процессе хранения тех или иных параметров модифицированной газовой среды.
Следует иметь в виду, что существует определенная избирательность цветочных культур к своему режиму хранения, который нужно устанавливать как с учетом некоторых расчетных предпосылок (снижение интенсивности дыхания), так и экспериментально. Все это в определенной степени затрудняет формулировку общих режимов хранения. Возможны значительные отступления от конкретных рекомендаций, чтобы достичь биологической стабилизации срезки, вегетативных органов или семян, по крайней мере в течение некоторого заданного срока. Такая биологическая стабилизация позволит снизить интенсивность биохимических реакций и избежать биологических расстройств, сопровождающихся ослаблением устойчивости растительных тканей к различным фитопатогенным микроорганизмам.
Предлагаемая читателям книга — не просто подборка материалов о хранении срезки, вегетативных органов и семян цветочных растений, она отражает быстро изменяющуюся картину совершенствования и развития новых технологий. При этом рассмотрены и старые традиционные технологии. Некоторые разделы книги представляют собой законченное целое, другие — могут служить исходным материалом для дальнейших исследований и разработок.
ЛИТЕРАТУРА
Белынская Е. В. Проводящая система цветочных побегов некоторых декоративных растений//Фитогормоны в процессах роста и развития растений. М., 1974.
Бражников А. М., Каугешвили Э. И. Холод. Введение в специальность. М.: Легкая и пищевая промышленность, 1984.
Вакуленко В. В. и др. Выращивание промышленного ассортимента цветочных культур: Экспресс-информация. Сер.: Озеленение населенных мест. М.: ЦБНТИ Минжилкоммунхоза РСФСР, 1979, вып. 1, № 27.
Гродзинский А. М. Жизнь срезанного цветка//Химия и жизнь. 1984, № 12.
Гэлстон А. и др. Жизнь зеленого растения. М.: Мир, 1983.
ДубягоВ. П. и др. Полимерные мембраны. М.: Химия, 1981.
Ждамиров Ю. И., Булаченкова Г. П. Способы хранения, упаковки и транспортировки срезанных цветов. М.: Россельхозиздат, 1975.
Журавленко В. Я. Гипобарическое хранение//Цветоводство, 1984, № 5.
Зленко И. Л. и др. Выращивание промышленного ассортимента цветочных культур: Экспресс-информация. Сер.: Озеленение населенных мест. М.: ЦБНТИ Минжилкоммунхоза РСФСР. 1979, вып. 1, № 27.
Игумнов М. А. Продление жизни срезанных цветов: Экспресс-информация. Сер.: Озеленение населенных мест. М.: ЦБНТИ ЛАин-жилкоммунхоза РСФСР, 1978, № 9.
Каплан С. Длительное хранение цветов и черенков//Цветоводство, 1980, № 1.
Клейн Р. М. Методы исследования растений. М.: Колос, 1974.
Колесник А. А. и др. Биохимические основы хранения плодоовощной продукции в РГС//Хранение плодоовощной продукции и картофеля. М.: Колос, 1983.
Корнилова Н. В., Рукавишников А. М., Стрельцов Б. Н. Регулирование газового состава в контейнерах с мембранами для хранения плодов и овощей//Химия в сельском хозяйстве, 1983, № 7.
Кульков О. В. и др. Измерение влажности воздуха в сельскохозяйственных целях. Л.: Гидрометеоиздат, 1977.
Кусильман Л. М. Содержание цветочной продукции в холодильных камерах//Цветоводство, 1978, № 3.
Манойлов В. Е. и др. Приборы контроля окружающей среды. М.: Атомиздат, 1980.
Никитаев А. М., Калачев С. Л. Контейнеры из полимерных материалов для хранения сельскохозяйственной продукции. М.: ВПНО «Союзсельхозхимия», 1980.
Никитаев А. М. и др. Хранение клубнелуковиц гладиолусов//Цветоводство, 1979, № 7.
Притула З. В. Хранение срезанных цветов гвоздики ремонтантной, тюльпанов и нарциссов при пониженных температурах. Сочи, 1976.
Притула З. В. Хвойный экстракт для сохранения гвоздики//Цветоводство, 1978, № 9.
Ругите Я. Выгонка тюльпанов//Цветоводство, 1986, № 5.
Рукавишников А. М., Стрельцов Б. Н. Промышленное хранение плодов и овощей в полимерных накидках с газоселективными мембранами//Химия в сельском хозяйстве, 1984, № 11.
Рукавишников A.M. Упаковка и хранение срезанных цветов и черенков: Экспресс-информация. Сер.: Заготовка, закупка, хранение и переработка плодоовощей. М.: ЦБНТЭИ Центросоюза, 1985, № 6.
Рукавишников А. М. и др. Новая технология хранения черенков//Цветоводство, 1985, № 2.
Стрельцов Б. Н., Рукавишников А. М., Коротанов В. А. Длительное хранение срезки и черенков//Цветоводство, 1982, Кя 1.
Стрельцов Б. Н., Рукавишников А. М. Холодильная техника для цветов//Цветоводство, 1985, № 4.
Федосеенко В. А. Использование сверхнизких температур для длительного хранения семян//Бюл. ВИР, 1978, вып. 77.
Andrё P. et al. Etude de la conservation apres recolte de fleurs, fruits et legumes au moyen de la prerefrigeration par la vide associee a des atmospheres modifiees.// — Revue Horticole, 1980.
№ 204. Alwater B. R. Germination, dormancy and morphology of the seeds of herbaceous ornamental plants.//Seed. Sci. Technol., 1980, 8. № 4. Come D. Post harvest physiology of seeds as related to quality and germinability.//«Post-harvest Physiology and Crop Preservation».
Plenum Press, NY, 1980. Justice O. L., et al. Principles and practices of seed storage.//Agric. Hand-book, 1978, № 506, Washington D. С Romero R. Las semillas des flores. Ministerio de Agriculture, Madrid, 1977.
О КНИГЕ
Стрельцов Борис Никодимович, Рукавишников Анатолий Михайлович, Коротанов Владимир Азарьевич — 'Хранение цветов'
Москва 1988
ВО "Агропромиздат"
Хранение цветов/Б. Н. Стрельцов, А. М. Рукавишников, В. А. Коротанов — М.: Агропромиздат, 1988. — 204 с, [4] л. ил.: ил.
С 3803030700-359 КБ-32-29-87 035(01)—88 ББК 42.374 С 84 УДК 635.9—156 ISBN 5-10-000400-2
Зав. редакцией И. П. Незговорова
Редактор Ю. М. Лейкина
Художник А. В. Шершуков
Художественный редактор С. Н. Болоболов
Слайды выполнены А. С. Севериным
Технический редактор С. В. Фельдман
Корректор В. И. Хомутова
ИБ № 5135
Сдано в набор 16.11.87.
Подписано к печати 21.06.88.
Т. 13127. Формат 84&Times;108
1/
32.
Бумага офс. № 1. Гарнитура Литературная.
Печать высокая.
Усл. печ. л. 10,92+0,42 цв. вкл.
Усл. кр. — отт. 13, 02.
Уч. — изд. л. 11,47+0,46 цв. вкл.
Изд. № 454.
Тираж 50 000 экз.
Заказ № 1012.
Ордена Трудового Красного Знамени ВО «Агропромиздат», 107807, ГСП-6,
Москва, Б-78, ул. Садовая-Спасская, 18.
Ярославский полиграфкомбинат Союзполиграфпрома при Государственном комитете СССР
по делам издательств, полиграфии и книжной торговли.
150014, Ярославль, ул. Свободы, 97.
Оглавление
ПРЕДИСЛОВИЕ
ГЛАВА 1. ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ В СРЕЗАННЫХ ЦВЕТАХ ПРИ ХРАНЕНИИ
ФИЗИОЛОГИЯ ЦВЕТЕНИЯ
ДЫХАНИЕ ЦВЕТОВ
ТРАНСПИРАЦИЯ
ФИТОГОРМОНЫ И ЭТИЛЕН
МИКРОФЛОРА СРЕЗАННЫХ ЦВЕТОВ
ГЛАВА 2. ХОЛОДИЛЬНОЕ ХРАНЕНИЕ СРЕЗАННЫХ ЦВЕТОВ И ЧЕРЕНКОВ
СРЕЗКА И ПОДГОТОВКА ЦВЕТОВ И ЧЕРЕНКОВ К ХРАНЕНИЮ
ХРАНЕНИЕ ЦВЕТОВ И ЧЕРЕНКОВ С ИСПОЛЬЗОВАНИЕМ ЛЬДА
ХРАНЕНИЕ ЦВЕТОВ И ЧЕРЕНКОВ В ХОЛОДИЛЬНЫХ КАМЕРАХ СУХИМ И ВЛАЖНЫМ СПОСОБАМИ
ПОДГОТОВКА ЦВЕТОВ К РЕАЛИЗАЦИИ И ЧЕРЕНКОВ К УКОРЕНЕНИЮ
ГЛАВА 3. УСОВЕРШЕНСТВОВАННЫЕ МЕТОДЫ ХРАНЕНИЯ СРЕЗАННЫХ ЦВЕТОВ И ЧЕРЕНКОВ
ХРАНЕНИЕ ЦВЕТОВ С ПОМОЩЬЮ ХИМИЧЕСКИХ СРЕДСТВ
ХРАНЕНИЕ ЦВЕТОВ С ПРИМЕНЕНИЕМ МНОГОКОМПОНЕНТНЫХ ФИЗИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ НА ОСНОВЕ СОЛЕЙ СЕРЕБРА
ХРАНЕНИЕ ЦВЕТОЧНОЙ ПРОДУКЦИИ С ПРИМЕНЕНИЕМ ФИЗИКО-ХИМИЧЕСКИХ СРЕДСТВ
ХРАНЕНИЕ СРЕЗАННЫХ ЦВЕТОВ И ЧЕРЕНКОВ ПРИ ПОНИЖЕННОМ ДАВЛЕНИИ
ХРАНЕНИЕ ЦВЕТОВ И ЧЕРЕНКОВ С ИСПОЛЬЗОВАНИЕМ АЭРООЗОННОЙ ОБРАБОТКИ
ГЛАВА 4. ХРАНЕНИЕ ЦВЕТОЧНОЙ ПРОДУКЦИИ В РЕГУЛИРУЕМОЙ И МОДИФИЦИРОВАННОЙ ГАЗОВОЙ СРЕДЕ
ХРАНЕНИЕ ЦВЕТОЧНОЙ ПРОДУКЦИИ В РГС
ГАЗОСЕЛЕКТИВНЫЕ МАТЕРИАЛЫ ДЛЯ СОЗДАНИЯ МОДИФИЦИРОВАННОЙ ГАЗОВОЙ СРЕДЫ
ОСНОВЫ СОЗДАНИЯ МОДИФИЦИРОВАННОЙ ГАЗОВОЙ СРЕДЫ ДЛЯ ХРАНЕНИЯ ЦВЕТОЧНОЙ ПРОДУКЦИИ
ТЕХНОЛОГИЯ ХРАНЕНИЯ ЦВЕТОЧНОЙ ПРОДУКЦИИ В МОДИФИЦИРОВАННОЙ ГАЗОВОЙ СРЕДЕ
ГЛАВА 5. ХРАНЕНИЕ СЕМЯН ЦВЕТОЧНЫХ КУЛЬТУР ОСОБЕННОСТИ МОРФОЛОГИИ И ФИЗИОЛОГИИ СЕМЯН
ОСНОВЫ ХРАНЕНИЯ СЕМЯН
ХРАНЕНИЕ СЕМЯН ПРИ СВЕРХНИЗКИХ ТЕМПЕРАТУРАХ
ЛИОФИЛЬНОЕ ХРАНЕНИЕ СЕМЯН
ХРАНЕНИЕ ПЫЛЬЦЫ
СНЯТИЕ С ХРАНЕНИЯ И ВОССТАНОВЛЕНИЕ ПОСЕВНЫХ КАЧЕСТВ СЕМЯН
ГЛАВА 6. ХРАНЕНИЕ ВЕГЕТАТИВНЫХ ОРГАНОВ ЦВЕТОЧНЫХ РАСТЕНИЙ ОСОБЕННОСТИ ФИЗИОЛОГИИ ЛУКОВИЦ И КЛУБНЕЛУКОВИЦ
ТРАДИЦИОННОЕ ХРАНЕНИЕ ЛУКОВИЦ И КЛУБНЕЛУКОВИЦ
ХРАНЕНИЕ ЛУКОВИЦ И КЛУБНЕЛУКОВИЦ В МОДИФИЦИРОВАННОЙ ГАЗОВОЙ СРЕДЕ
ПРИМЕНЕНИЕ ЭЛЕКТРОФИЗИЧЕСКОЙ ОБРАБОТКИ ПРИ ХРАНЕНИИ ЛУКОВИЦ И КЛУБНЕЛУКОВИЦ
ХРАНЕНИЕ КОРНЕВЫХ ЧЕРЕНКОВ
СНЯТИЕ ЛУКОВИЦ И КЛУБНЕЛУКОВИЦ С ХРАНЕНИЯ, ИХ ПРЕДПОСАДОЧНАЯ ОБРАБОТКА
ГЛАВА 7. ТЕХНИЧЕСКИЕ СРЕДСТВА ДЛЯ ХРАНЕНИЯ ЦВЕТОЧНОЙ ПРОДУКЦИИ
ХОЛОДИЛЬНАЯ ТЕХНИКА
ТЕХНИЧЕСКИЕ СРЕДСТВА ХРАНЕНИЯ ЦВЕТОЧНОЙ ПРОДУКЦИИ В РЕГУЛИРУЕМОЙ ГАЗОВОЙ СРЕДЕ
ТЕХНИЧЕСКИЕ СРЕДСТВА ХРАНЕНИЯ ЦВЕТОЧНОЙ ПРОДУКЦИИ В МОДИФИЦИРОВАННОЙ ГАЗОВОЙ СРЕДЕ
ТЕХНИЧЕСКИЕ СРЕДСТВА ГИПОБАРИЧЕСКОГО ХРАНЕНИЯ ЦВЕТОЧНОЙ ПРОДУКЦИИ
ЭЛЕКТРОФИЗИЧЕСКАЯ ТЕХНИКА ДЛЯ ХРАНЕНИЯ ЦВЕТОЧНОЙ ПРОДУКЦИИ
ГЛАВА 8. КОНТРОЛЬНО-ИЗМЕРИТЕЛЬНАЯ АППАРАТУРА, ПРИМЕНЯЕМАЯ ПРИ ХРАНЕНИИ ЦВЕТОЧНОЙ ПРОДУКЦИИ
ОПРЕДЕЛЕНИЕ ИНТЕНСИВНОСТИ ДЫХАНИЯ И ДЫХАТЕЛЬНОГО КОЭФФИЦИЕНТА ЦВЕТОЧНОЙ ПРОДУКЦИИ
ИЗМЕРЕНИЕ ВОДНОГО ПОТЕНЦИАЛА И ТРАНСПИРАЦИИ СРЕЗАННЫХ ЦВЕТОВ
ГИДРАВЛИЧЕСКАЯ ПРОНИЦАЕМОСТЬ И КОЭФФИЦИЕНТ ПРОНИЦАЕМОСТИ СРЕЗАННЫХ ЦВЕТОВ
ИЗМЕРЕНИЕ ВЛАЖНОСТИ И ТЕМПЕРАТУРЫ ВОЗДУХА В ХРАНИЛИЩЕ
АНАЛИЗ ГАЗОВОГО СОСТАВА АТМОСФЕРЫ ХРАНИЛИЩА
ПОСЛЕСЛОВИЕ
ЛИТЕРАТУРА
О КНИГЕ




















































































